Text
Definição de Criminalística
O termo “Criminalística” foi utilizado pela primeira vez por HANS GROOS, o pai da criminalística. Também já foi chamada de antropologia criminal, psicologia criminal, ciência policial, policiologia, técnica policial, polícia técnica, polícia científica, polícia criminal e polícia judiciária. É uma disciplina para pesquisa, análise e interpretação dos vestígios materiais EXTRÍNSECOS encontrados em locais de crime, com o objetivo de determinar a materialidade e a autoria da infração penal. É autônoma, independente, mas integrada pelos diferentes ramos do conhecimento técnico-científico, auxiliar e informativa à Polícia e à Justiça. A medicina legal, por sua vez, cuida dos vestígios intrínsecos (na pessoa).
A moderna criminalística objetiva demonstrar a dinâmica dos fatos, com análise e interpretação dos vestígios materiais, interligação entre eles, bem como fatos geradores, origem, meios e modos como foram perpetrados os delitos. A conceituação abrangente, considerando aspectos estruturais, funcionais e dinâmicos, envolve:
a) Disciplina autônoma/independente: regida por leis, métodos e princípios próprios;
b) Procedimento multidisciplinar: os subsídios técnico-científicos são fornecidos pelos mais variados ramos do conhecimento;
c) Auxiliar e informativa às atividades policiais e judiciárias: fornecem bases para corretas e mais justas decisões do juízo.
d) Caráter utilitário: sempre que restarem vestígios materiais pelas infrações penais, o concurso da Criminalística se fará necessariamente presente.
e) Objeto: todos os vestígios materiais, suspeitos ou não, encontrados no local do fato. Alguns vestígios não materiais também serão analisados (p.ex. determinação de velocidade de veículo, variações emocionais de exames escritos, estimativas de distância, lapso de tempo entre sons e ruídos percebidos, capacidade de percepção visual de objetos à distância, etc.);
f) Classificação: peritos criminalísticos, peritos criminalísticos químicos, peritos criminalísticos engenheiros + papiloscopistas e fotógrafos criminalísticos (algumas unidades da federação) ou peritos criminas, peritos médico-legistas e peritos odonto-legistas (Lei 12.030/09).
Referência: Victor Paulo Stumvoll, Criminalística, 6ª edição. 2014. Editora: Millenium.
3 notes
·
View notes
Text
Dosagem de Enzimas
As enzimas são proteínas com propriedadescatalisadoras sobre as reações que ocorrem nos sistemas biológicos. Elas têm umelevado grau de especificidade sobre seus substratos, acelerando reaçõesespecíficas sem serem alteradas ou consumidas durante o processo. Todas asenzimas presentes no corpo humano são sintetizadas intracelularmente. Trêscasos se destacam:
Enzimas plasma-específicas:enzimas ativas no plasma utilizadas no mecanismo de coagulação sanguínea efibrinólise. Ex.: pró -coagulantes: trombina, fator XII, fator X e outros.
Enzimas secretadas: sãosecretadas geralmente na forma inativa e após ativação atuam em locaisextracelulares. Ex.: proteases, hidrolases, lipase, alfa-amilase,tripsinogênio, fosfatase ácida prostática e antígeno prostático específico.Muitas são encontradas no sangue.
Enzimas celulares: normalmenteapresentam baixos níveis séricos, mas aumentam quando são liberadas a partir detecidos lesados. Ex. transaminases,lactato desidrogenases etc.
Aumento na liberação de enzimas para o plasma é consequência de:
Lesão celular extensa, causadas, geralmente, por isquemia ou toxinas celulares. Ex.: aumento da creatina quinase (CK-MB) após infarto do miocárdio.
Proliferação celular e aumento na renovação celular. Ex.: aumento da fosfatase alcalina (FA) pela elevação da atividade osteoblástica durante o crescimento ou restauração óssea após fraturas.
Aumento na síntese enzimática. Ex.: aumento da gama-glutamil transferase (GGT) após a ingestão de álcool.
Obstrução de ductos, que afeta as enzimas normalmente encontradas nas secreções exócrinas. Ex.: amilase e lipase no suco pancreático, que podem regurgitar para a corrente circulatória se o ducto pancreático-biliar estiver bloqueado.
Redução da remoção de enzimas do plasma por Insuficiência Renal, que afeta as enzimas excretadas na urina. Ex.: aumento de amilase no sangue e diminuição na urina.
Redução nos níveis de atividade enzimática é menos comum e consequência de:
Síntese enzimática reduzida. Ex.: diminuição da colinesterase (CHE) na insuficiência hepática pela redução do número de hepatócitos.
Deficiência congênita. Ex.: diminuição da atividade da FA na hipofosfatasemia congênita.
Variantes enzimáticas inerentes com baixa atividade biológica. Ex.: variantes anormais da CHE.
As alterações nas atividades enzimáticas fornecem indicadores sensíveis de lesão ou proliferação celular. Estas modificações ajudam a detectar e, em alguns casos, localizar a lesão tecidual, monitorar o progresso da doença e o tratamento. No entanto, muitas vezes falta especificidade, isto é, existem dificuldades em relacionar a atividade enzimática aumentada com os tecidos lesados porque as enzimas não estão confinadas a tecidos ou órgãos específicos, mas estão distribuídas e suas atividades podem refletir desordens envolvendo vários tecidos.
1. AMILASE
Investigação da doença pancreática.
Enzima da classe das hidrolases, que catalisa a clivagem do amido e do glicogênio.
Moléculas pequenas, facilmente filtradas pelo glomérulo renal; é a ÚNICA enzima plasmática encontrada normalmente na URINA.
Produzida por: (a) glândulas salivares (tipo S), secretada para boca e esôfago; (b) células acinares do pâncreas (tipo P), secretada pelo ducto pancreático para o trato intestinal.
Também encontrada: (a) ovários, tubas uterinas; (b) testículos, sêmen; (c) pulmões; (d) músculos estriados; (e) tecido adiposo.
AUMENTO SÉRICO
Pancreatite aguda. Aumento de 2-12 h após o início da dor abdominal e atinge o pico entre 12-72 h. Magnitude da elevação não se correlaciona com severidade do envolvimento pancreático.
Lesões traumáticas do pâncreas, carcinoma de pâncreas, com obstrução dos ductos pancreáticos.
Insuficiência renal por declínio da depuração. Os aumentos são proporcionais à extensão do comprometimento renal.
Lesões das glândulas salivares.
Doença abdominal (peritonite, apendicite, obstrução intestinal, úlceras).
Doença do trato biliar.
Neoplasias de pulmão e ovário.
Cetoacidose diabética.
Queimaduras e choques traumáticos.
Alcoolismo agudo, drogas.
AUMENTO URINÁRIO (hiperamilasúria): reflete as elevações séricas da amilase. Na pancreatite aguda a reabsorção tubular da amilase está reduzida, aumentando seus níveis na urina, o que ocorre também em quase todas as situações que elevam a amilase sérica.
DEPURAÇÃO DA AMILASE (Clearence): a relação entre a depuração renal da amilase e a depuração da creatinina é útil no diagnóstico diferencial da pancreatite aguda. Nesta patologia, a depuração renal da amilase é, geralmente, maior do que a depuração da creatinina causando elevação na relação.
Amilase na urina (U/dL) creat.no soro (mg/dL) x 100 = %
Amilase no soro creat.na urina (mg/dL)
DETERMINAÇÃO DA AMILASE
Paciente: não é exigida preparação especial.
Amostra: soro sem hemólise e não-lipêmico. A atividade amilásica necessita de cálcio e cloretos como cofatores, sendo os anticoagulantes quelantes, como o citrato e o oxalato e EDTA, impróprios para estas amostras. Urina colhida no período de 1 h ou de 24 h sem conservantes. Soro e urina livres de contaminação bacteriana são estáveis por uma semana em temperatura ambiente ou por vários meses sob refrigeração.
Valores de referência:
Soro de adultos 60 a 160 U/dL (Somogyi)
Urina 1500 a 1800 U/d (Somogyi) ou 70-275 U/h
Clearence 1,4 a 3,8%
Influências pré-analíticas e fatores interferentes:
Fatores que aumentam a dosagem: biológicos (idade, contaminação com saliva, macroamilasemia); drogas (morfina, heroína, codeína, diuréticos, salicilatos, tetraciclina).
Fatores que diminuem a dosagem: álcool; hipertrigliceridemia; hemólise; icterícia; plasma colhido com EDTA, citrato e fluoreto.
Exames relacionados: dosagem de lipase, clearence de amilase.
2. LIPASE
Investigação da doença pancreática.
Enzima que catalisa a hidrólise dos ésteres de glicerol dos triglicerídios em presença de sais biliares de cofator colipase.
Produzida por: (a) células acinares do pâncreas.
Também encontrada: (a) mucosa intestinal, leucócitos, adipócitos.
AUMENTO SÉRICO: medida usada exclusivamente para diagnóstico de desordens pancreáticas.
Pancreatite aguda. Aumento entre 4-8 horas, após início do quadro, atingindo pico em 24 h. A atividade lipásica não é necessariamente proporcional à severidade do ataque.
Pancreatite crônica. Os níveis caem nos últimos estágios da doença devido à destruição das células acinares.
Obstrução do ducto pancreático.
DETERMINAÇÃO DA LIPASE
Paciente: não é exigido cuidados especiais.
Amostra: soro isento de hemólise. É estável por uma semana no refrigerador ou por vários meses a -20 ºC.
Valores de referência:
Soro de adultos: 0,1 a 1,0 Ud (Cherry –Crandall) ou 28 a 280 U/L (internacionais)
Influências pré-analíticas e fatores interferentes
Fatores que aumentam a dosagem: biológicos (idade); drogas (opiáceos, morfina); hipertrigliceridemia; hemólise; icterícia.
Fatores que diminuem a dosagem: plasma EDTA, citrato e fluoreto.
Exames relacionados: dosagem de amilase.
3. TRIPSINA
Investigação da doença pancreática.
Enzima proteolítica que hidrolisa ligações peptídicas entre os grupos carboxila de lisina ou de arginina com outros aminoácidos.
Produzida por: (a) células acinares do pâncreas, na forma precursora de tripsinogênio inativo, que é secretado no duodeno e convertido em tripsina.
A tripsina está presente nas fezes de crianças pequenas, com redução dos teores em crianças maiores e em adultos, pela sua destruição por bactérias intestinais.
AUSÊNCIA NAS FEZES
Insuficiência pancreática
Pancreatite crônica
Fibrose cística (avançada)
4. FOSFATASE ALCALINA (FAL)
Investigação da função hepática (doença hepatobiliar) e doença óssea.
Grupo de enzimas que catalisam a hidrólise de uma variedade de substratos em pH alcalino. Apesar da exata função metabólica da enzima ser desconhecida, parece estar associada com o transporte lipídico no intestino e com processos de calcificação óssea.
Produzida por: (a) fígado; (b) ossos (osteoblastos).
Também encontrada: (a) mucosa intestinal; (b) túbulos renais; (c) placenta.
AUMENTO SÉRICO
Doença hepatobiliar:
Obstrução da árvore biliar (colestase);
Carcinoma hepatocelular;
Hepatites virais e cirrose (pequeno aumento
Doenças ósseas (hiperatividade osteoblástica)
Gravidez (no 3º trimestre). Aumentos ou reduções inexplicáveis predizem complicações na gravidez como hipertensão ou pré-eclâmpsia.
DETERMINAÇÃO DA FOSFATASE ALCALINA
Paciente: jejum por 8 h antes da coleta. Evitar ingestão de refeição rica em gorduras.
Amostra: soro ou plasma heparinizado. Evitar hemólise, pois os eritrócitos contêm FA. O ensaio deve ser realizado logo que possível após a coleta, pois a FA não é muito estável.
Valores de referência (4-nitrofenilfosfato – Bowers):
Adultos 20 a 105 U/L
Crianças de 0 a 3 meses 70 a 220 U/L
Crianças de 3 meses a 10 anos 60 a 150 U/L
Jovens de 10 a 15 anos 60 a 260 U/L
Influências pré-analíticas e fatores interferentes:
Fatores que aumentam a dosagem: biológico (idade, gravidez, sexo); drogas (morfina)
Fatores que diminuem a dosagem: hemólise; drogas (anticoncepcionais orais, hipolipemiantes, anticoagulantes, antiepilépiticos); plasma colhido com EDTA, citrato e fluoreto.
Exames relacionados: fosfatase alcalina óssea específica; gama-glutamiltransferase.
5. AMINOTRANSFERASES (TRANSAMINASES)
Investigação da função hepática e cardíaca.
As enzimas aspartato aminotransferase, AST (transaminase glutâmica-oxalacética, TGO) e alanina aminotransferase, ALT (transaminase glutâmica-pinúvica, TGP) catalisam a transferência reversível dos grupos amino de um aminoácido para o a-cetoglutarato, formando cetoácido e ácido glutâmico. Exercem papéis centrais tanto na síntese como na degradação de aminoácidos.
Atividades mais elevadas de AST (TGO) encontram-se no miocárdio, no fígado e no músculo esquelético, com pequenas quantidades nos rins, pâncreas, baço, cérebro, pulmões e eritrócitos, sendo esta uma enzima bilocular, ou seja, está presente no citoplasma e, principalmente, nas mitocôndrias (80%).
Atividades de ALT (TGP) concentram-se no fígado e nos rins, sendo esta uma enzima unilocular, presente exclusivamente no citoplasma das células.
AUMENTO SÉRICO
Desordens hepatocelulares. Como AST (TGO) e ALT (TGP) são enzimas intracelulares presentes em grandes quantidades no citoplasma dos hepatócitos, lesões ou destruição das células hepáticas liberam estas enzimas para a circulação. Em dano hepatocelular leve, a forma predominante no soro é citoplasmática, enquanto em lesões graves há liberação da enzima mitocondrial, elevando a relação AST/ALT.
Hepatite aguda: relação AST/ALT < 1. Geralmente, ALT tem maior atividade que AST. Aumento das aminotransferases entre 20 e 50 vezes dos valores de referência uma a duas semanas antes do início dos sintomas, podendo estar acompanhado de hiperbilirrubinemia, de bilirrubinúria e de pequena elevação dos níveis séricos da fosfatase alcalina.
Cirrose hepática: relação AST/ALT > 1. Nestes casos, AST tem maior atividade que ALT. Aumento das aminotranferases até 5 vezes dos valores de referência. A disfunção hepatocelular provoca a síntese prejudicada da albumina, além do prolongamento do tempo de protrombina, hiperbilirrubinemia, teores de amônia elevadas e uremia baixa. Aumentos das aminotransferases semelhantes aos encontrados na cirrose, são na colestase extrahepática, carcinoma de fígado, ingestão de álcool, durante o “delirium tremens” e após administração de drogas como opiatos, salicilatos ou ampicilina.
Mononucleose infecciosa, causada por Epstein Baar Vírus (EBV). Aumento de até 20 vezes os valores de referência, com o envolvimento hepático.
Infarto do miocárdio. Aumento de AST por volta de 6 a 8 horas após o infarto do miocárdio, atingindo o pico (20 a 200 U/mL) entre 18 e 24 horas e retornando aos valores de referência pelo 5º dia. A AST não altera na angina pectoris, pericardite e enfermidade vascular miocárdica.
Insuficiências cardíaca congestiva: AST pode estar aumentado de leve a moderado.
Distrofia muscular progressiva e dermatomiosite: aumento da AST de 4-8 vezes e, ocasionalmente, da ALT.
DETERMINAÇÃO DAS TRANSAMINASES
Paciente: não necessita cuidados especiais.
Amostra: soro isento de hemólise, pois a atividade das aminotransferases é maior nos eritrócitos. A atividade da enzima permanece inalterada por 24 horas em temperatura ambiente e mais de uma semana sob refrigeração.
Valores de referência a 37 ºC (U/L)
AST (GOT): 5 a 34
ALT (GTP): 6 a 37
Influências pré-analíticas e fatores interferentes
Fatores que aumentam a dosagem: biológico (idade, gravidez, exercícios, uso de álcool); hemólise; icterícia; hipertrigliceridemia; drogas (paracetamol, alfametildopa, carbamazepina, heparina halotano, isoniazida, nitrofurantoína, ácido valpróico, sulfonamidas, anti-inflamatórios (não esteróides)); toxinas (clorofórmio, hidrazina, tricloroetileno, tolueno); drogas ilícitas: cocaína, “ecstasy”, esteroides anabolizantes.
Fatores que diminuem a dosagem: deficiência de vitamina B6.
6. GAMA-GLUTAMILTRANSFERASE (GGT)
Investigação da função hepática.
Enzima catalisa a transferência de um grupo g-glutamil de um peptídeo para outro ou para um aminoácido, produzindo aminoácidos ou peptídeos menores. Está envolvida no transporte de aminoácidos e de peptídeos através das membranas celulares, na síntese proteica e na regulação dos níveis de glutatião tecidual.
Produzida: (a) fígado, principalmente, nos ductos biliares e por isto é um marcador sensível das situações em que ocorre obstrução biliar.
Também encontrada: (a) rim; (b) pâncreas; (c) intestino; (d) próstata; (e) cérebro e (f) coração.
AUMENTOS SÉRICO
Desordens hepatobiliares
Colestase* do trato biliar (processo primário da cirrose biliar): colestase intra-hepática e obstrução biliar extra-hepática. Aumento de 5 a 30 vezes dos valores de referência.
* Colestase é uma diminuição ou interrupção do fluxo de bílis.
GGT é mais sensível e duradoura que a fosfatase alcalina, além de ser útil na diferenciação da fonte de elevação da FA, já que apresenta valores normais nas desordens ósseas e durante a gravidez. GGT é particularmente importante na avaliação do envolvimento hepatobiliar em adolescentes, pois a atividade da FA está elevada durante o crescimento ósseo.
Hepatites infecciosas. Aumento de 2 a 5 vezes dos valores de referência, mas, nestes casos, a determinação das aminotranferases é de maior utilidade.
Enfermidades hepáticas induzidas pelo álcool. A liberação da GGT no soro reflete os efeitos tóxicos do álcool e drogas (ex.: fenitoína e fenobarbital) sobre as estruturas microssomiais das células hepáticas. Nos alcoólatras, o aumento varia entre 2 a 3 vezes os valores de referência. Por outro lado, a ingestão de álcool em ocasiões sociais não aumenta, significativamente. O diagnóstico do uso de álcool pode ser complementado pelos testes: volume celular médio (VCM) dos eritrócitos, indicando macrocitose, transferrina deficiente em carboidratos (CDT) e etanol sanguíneo. Esteatose hepática (fígado gorduroso) é a mais comum das hepatopatias alcoólicas.
(c) Neoplasmas hepáticos ou metastáticos e câncer prostático.
Apesar da GGT ser encontrada no pâncreas e rins, a enzima não eleva em desordens nestes órgãos a menos que exista envolvimento hepático.
DETERMINAÇÃO DA GGT
Paciente: jejum por 8 horas, à exceção da ingestão de água. Além disso, não deve ingerir álcool durante 24 horas antes da prova.
Amostra: soro. Estável por uma s emana em temperatura ambiente. Quando congelada é estável por 3 meses.
Valores de referência (U/L)
Homens: 5 a 25
Mulheres 8 a 40
Influências pré-analíticas e fatores interferentes:
Fatores que aumentam a dosagem da enzima: biológicos (álcool); drogas (fenitoína, fenobarbital, carbamazepina, ácido valpróico, contraceptivos orais).
Fatores que diminuem a dosagem da enzima: drogas (azatioprina, clofibrato, estrógenos e metronidazol); hemólise; anticoagulantes (heparina, citrato, fluoreto).
Exames relacionados: dosagem de fosfatase alcalina.
7. LACTATO DESIDROGENASE (LD)
Investigação de doenças com envolvimento muscular, que cursam com injúria tissular.
Enzima da classe das oxidorredutases que catalisa a oxidação reversível do lactato a piruvato, em presença da coenzima NAD+ que atua como doador ou aceptor de hidrogênio. A LD está presente no citoplasma de todas as células do organismo.
Rica em: (a) miocárdio; (b) fígado; (c) músculo esquelético; (d) rim e (e) eritrócitos. Os níveis teciduais de LD são, aproximadamente, 500 vezes maiores do que os encontrados no soro e lesões naqueles tecidos provocam elevações plasmáticas significantes desta enzima.
É possível obter informações de maior significado clínico pela separação da LD em suas cinco frações isoenzimáticas, designadas de acordo com sua mobilidade eletroforética. Cada isoenzima é um tetrâmero formado por quatro subunidades chamadas H (cadeia polipeptídica cardíaca – heart) e M (cadeia polipeptídica muscular esquelética – muscle). As cinco isoenzimas encontrados no soro são:
LD-1 (HHHH), 14-26%: coração e eritrócitos
LD-2 (HHHM), 29-39%: coração e eritrócitos
LD-3 (HHMM), 20-26%: pulmão, linfócitos, baço, pâncreas
LD-4 (HMMM), 8-16%: fígado, músculo esquelético
LD-5 (MMMM), 6-16%: fígado, músculo esquelético
Hemólise durante a coleta e/ou manipulação de sangue eleva as frações LD -1 e LD-2.
AUMENTO SÉRICO
Infarto agudo do miocárdio (LD-1 e LD-2). Aumento em 8 a 12 horas após o infarto, atingindo o pico entre 24-48 horas, permanecendo aumentados por 7 a 12 dias.
Insuficiência cardíaca congestiva, miocardite, insuficiência circulatória (LD-1 e LD-2).
Anemia megaloblástica (LD-1 e LD-2). Deficiência de folato ou vitamina B12 causa destruição das células precursoras dos eritrócitos na medula óssea e aumenta a enzima sérica.
Desordens hepatobiliares; hepatite, cirrose e icterícia obstrutiva.
Doenças malignas, especialmente aquelas com metástases hepáticas.
(Mononucleose infeciosa.
Doenças renais.
(Distrofia muscular progressiva, trauma muscular e exercícios muito intensos (LD-5).
Embolia pulmonar (LD-3)
AUMENTO NA URINA
Gromerulonefrite crônica
Lúpus eritematoso sistêmico (LES)
LACTATO DESIDROGENASE no líquido cefalorraquidiano (LCR)
Em condições normais a atividade da LD no LCR é bem menor do que a do soro. A distribuição isoenzimática é LD1>LD3>LD2>LD4>LD5.
Meningite bacteriana: granulocitose resultante produz elevações da LD -4 e LD-5,
Meningite viral: linfocitose provoca elevações da LD -1 e LD-3.
DETERMINAÇÃO DA LD
Paciente: não é exigido preparo especial.
Amostra: soro ou plasma heparinizado, urina ou LCR. O soro e plasma devem estar isentos de hemólise. Estável por 24 h em temperatura ambiente. Não refrigerar.
Valores de referência (U/L)
Soro 95 a 225
Urina 42 a 98
Líquido cefalorraquidiano 7 a 30
Influências pré-analíticas e fatores interferentes:
Fatores que aumentam a dosagem: biológicos (idade, exercícios físicos, gravidez); trombocitose; procedimentos (transfusão de sangue, agitação intensa dos tubos de coleta), hemólise (afeta principalmente LDH1 e LDH2); icterícia.
Fatores que diminuem a dosagem: congelamento da amostra; lipemia; ácido ascórbico e oxalato.
Exames relacionados: CK total.
8. CREATINA QUINASE (CK)
Investigação de doenças com envolvimento muscular.
Enzima catalisa a fosforilação reversível da creatina pela adenosina trifosfato (ATP) com a formação de creatina fosfato. A CK está associada com a geração de ATP nos sistemas contráteis ou de transporte. A creatina quinase está amplamente distribuída nos tecidos
Rica em: (a) músculo esquelético; (b) tecido cardíaco; (c) cérebro. Não está presente no fígado nem nos eritrócitos. A CK consiste em três frações isoenzmáticas. Cada isoenzima é um dímero formado por duas subunidades chamadas B (cérebro – brain) e M (muscular – muscle). As três isoenzimas encontrados no soro são:
CK-BB ou CK-1, encontrada predominantemente no cérebro, raramente no sangue.
CK-MB ou CK-2, forma híbrida, predominante no miocárdio.
CK-MM ou CK-3, predominante no músculo esquelético.
Estas isoenzimas são encontradas no citosol ou associadas a estruturas miofibrilares. O soro normal contém cerca de 94-100% de CK-MM. O músculo esquelético contém quase inteiramente CK-MM, com pequenas quantidades de CK-MB. O músculo cardíaco também tem maior atividade atribuída a CK-MM, porém CK-MB está confinada quase exclusivamente no tecido cardíaco, sendo de grande significado diagnóstico no infarto agudo do miocárdio.
AUMENTO SÉRICO
Infarto agudo do miocárdio. Aumento em 3 a 8 horas após o infarto, atingindo um pico entre 12 e 24 horas, retornando aos seus níveis basais dentro de 3 a 4 dias.
Miocardite.
Angina pectoris, taquicardia, insuficiência cardíaca congestiva, procedimentos cardíacos e etc. elevam em níveis moderados CK total e/ou CK-MB, podendo mascarar infartos do miocárdio.
Enfermidades do músculo esquelético, como a Distrofia muscular progressiva de Duchene (distúrbio recessivo ligado ao cromossomo X), miosite, polimiosite.
Lesões no sistema nervoso central (SNC).
Hipotireoidismo.
DETERMINAÇÃO DA CK
Paciente: se a dosagem tiver por objetivo a avaliação de distúrbios da musculatura esquelética, o paciente deve evitar exercícios vigorosos durante 24 h. Não ingerir álcool no dia anterior ao teste. Suspender as drogas que afetam os resultados das dosagens durante 24 h.
Amostra: Soro, plasma (heparinizado) isentos de hemólise, LCR e líquido amniótico. Icterícia e lipemia podem interferir em leituras de absorvâncias. Em refrigerador e no escuro, as amostras são estáveis por uma semana. A –20ºC conservam-se por mais de um mês.
Valores de referência (U/L)
Homens 15 a 160
Mulheres 15 a 130
Influências pré-analíticas e fatores interferentes
Fatores que aumentam a dosagem: biológicos (sexo, idade, massa muscular, atividade física, raça, uso de álcool); hemólise intensa; icterícia; drogas (corticoides, fenotiazidas, cocaína).
Fatores que diminuem a dosagem: exposição da amostra à luz; lipemia.
Exames relacionados: dosagem de troponina (cTnT e cTnI); dosagem de desidrogenase lática.
9. ALDOLASE (ALD)
Investigação de doenças com envolvimento muscular.
Pertence à classe das liases encontradas em todas as células do organismo.
Ricas em: (a) músculo esquelético; (b) fígado; (c) cérebro.
AUMENTO SÉRICO
Doenças musculares, como acompanhamento da distrofia muscular progressiva.
Hepatite aguda
Infarto do miocárdio
DETERMINAÇÃO DA ALD
Paciente: necessário pelo menos 30 minutos de repouso antes da coleta da amostra para evitar a interferência da atividade muscular.
Amostras: livres de hemólise.
Valores de referência 30ºC (U/L):
Recém-nascidos < 32
Crianças < 16
Adultos < 1,0 a 7,5
10. FOSFATASE ÁCIDA
Investigação de doenças prostáticas.
Grupo heterogênio não-específico de fosfatases que catalisam a hidrólise de monoéster ortofosfórico produzindo um álcool e um grupo fosfato. A fosfatase ácida é amplamente distribuída nos tecidos.
Nos homens, é rica em: (a) glândula prostática (50%); (b) fígado; (c) eritrócitos; (d) plaquetas.
Nas mulheres, é rica em: (a) fígado; (b) eritrócitos; (c) plaquetas
AUMENTO SÉRICO
Neoplasia prostática metastática (câncer na glândula – níveis normais)
Hiperplasia prostática benigna: hipertrofia pode causar compressão ou obstrução do sistema ductal prostático com regurgitação da enzima no soro.
Doença de Paget.
Doença de Gaucher.
Hiperparatireoidismo.
DETERMINAÇÃO DA FOSFATASE ÁCIDA
Paciente: não é exigido preparo especial.
Amostra: Soro ou plasma heparinizado isento de hemólise e não lipêmicos. Separar o soro ou plasma dos eritrócitos logo que possível. A enzima é estabilizada na amostra por acidificação. Nestas condições a atividade enzimática é mantida por várias horas em temperatura ambiente ou por uma semana no refrigerador.
Valores de referência (Roy)
Adultos 0,5 a 1,9 U/L
Influências pré-analíticas e fatores interferentes
Fatores que aumentam a dosagem: clofibrato.
Fatores que diminuem a dosagem: etanol e estrogênio -terapia para o carcinoma de próstata.
11. COLINESTERASE
Investigação da função hepática, através da sua diminuição sérica.
Duas enzimas tem a capacidade de hidrolizar acetilcolina para formar colina e o ácido correspondente. Uma é a acetilcolinesterase ou colinesterase I, responsável pela rápida hidrólise da acetilcolina liberada nas terminações nervosas para mediar a transmissão do impulso nervoso através da sinapse. Esta não é encontrada no plasma. A outra é a acilcolina acilhidrolase, pseudocolinesterase ou colinesterase II (CHE), que hidrolisa tanto ésteres não-colina como a acetilcolina. Atua em inativar a acetilcolina.
Produzida por: (a) fígado.
Encontrada também: (b) soro e (c) matéria branca do cérebro e soro;
AUMENTO SÉRICO
Alcoolismo,
Síndrome nefrótica
Câncer de mama
Hiperlipoproteinemia do tipo IV
Obesidade
DIMINUIÇÃO SÉRICA: menor síntese
Desordens hepatocelulares
Doença renal crônica
Anemias
Dermatomiosite,
Infarto do miocárdio
Desnutrição
Intoxicação inseticidas organofosforado
Apneia por relaxante muscular
Valores de referência: 3.500 a 8.500 U/L.
Referências
Motta, V., T. Bioquímica Clínica: princípios e interpretações. Disponível em http://www.labclinisul.com.br/artigos/Bioq.Clinica%20-%20Enzimas.pdf, acesso em 11/02/2015.
Resende, L., M., H.; Viana, L., G. e Vidigal, P., G. Protocolos Clínicos dos Exames Laboratoriais. Secretaria de Estado de Saúde de Minas Gerais, Universidade Federal de Minas Gerais, 2009. Disponível em http://www.uberaba.mg.gov.br/portal/acervo/saude/arquivos/oficina_10/protocolos_exames_laboratoriais.pdf, acesso em 11/02/2015.
3 notes
·
View notes
Text
Avaliação Laboratorial do Sistema Imunológico
Sistema Imunológico
Inespecífico:fagócitos (neutrófilos e macrófagos) e complemento
Específico:humoral (linfócitos B) e celular (linfócitos T)
Imunodeficiência: é um grupo de doenças caracterizadas por um ou maisdefeitos do sistema imunológico inato ou adaptativo. Como consequência destasalterações, o indivíduo se torna mais propenso a infecções. Existem dois gruposde alterações imunológicas: (1) imunodeficiências primárias ou congênitas,constituídas por defeitos genéticos hereditários, e (2) imunodeficiênciassecundárias, não hereditárias, mas secundárias a outras condições, comoinfecções virais, parasitárias, doenças autoimunes, desnutrição e etc.
As anormalidades do sistema imunológico relacionam-se a um tipo específico de infecção, de modo que a deficiência na produção de anticorpos aumentará a chance de infecções bacterianas extracelulares, enquanto a deficiência na imunidade celular aumentará a chance de infecções virais, fúngicas, protozoárias e de micobactérias. Sendo assim, na suspeita de uma imunodeficiência, deve-se solicitar exames que vão dar mais informações de acordo com a história clínica.
Infecções de repetição por bactérias extracelulares: sugerem deficiência predominantemente de anticorpos ou deficiência de proteínas do sistema complemento.
Infecções por bactérias intracelulares e germes oportunistas: sugerem deficiência da imunidade celular.
Abscessos de repetição: comum nas deficiências de fagócitos, sendo o Staphilococcus aureus o agente etiológico principal.
1. Imunodeficiências Primárias
1.1. Distúrbio de Neutrófilos
Neutropenia; diminuição no número e na função dos neutrófilos por defeito na maturação das células na medula óssea.
Predispõe indivíduos a infecções bacterianas.
Anomalia de Pelger-Hüet (hipossegmentação, segmentação incompleta do núcleo dos granulócitos); Síndrome de Chediak-Higoshi (granulações primárias gigantes em pequenas quantidades nos leucócitos), ambas doenças autossômicas recessivas.
1.2. Deficiência nas Moléculas de Aderência
Leucocitose neutrofílica.
Predispõe indivíduos a infecções bacterinas e fúngicas recorrentes.
Deficiência ou mutação na beta-integrina, de modo que neutrófilos respondem à infecção, mas não chegam ao local.
1.3. Deficiência do Complemento
Diminuição de C3 e C5, impedindo a opsonização e a destruição de microrganismos bacterianos.
Predispõe indivíduos a infecções bacterianas.
1.4. Deficiência de Linfócitos T e B
Diminuição da produção dos LT e LB, prejudicando tanto a resposta celular quanto a produção de anticorpos. Ocorre a hipoplasia de tecidos linfoides.
Predispõe indivíduos a infecções recorrentes, septicemia, pneumonia.
Imunodeficiência Combinada Severa (imunodeficiência mais grave, doença autossômica recessiva que causa défice de LT e de LB), Síndrome de Wiskott-Aldriclh (doença recessiva ligada ao X, que envolve LT, LB e diminuição das plaquetas).
2. Imunodeficiências Secundárias
2.1. Falha na transferência de anticorpos maternos
2.2. Imunossupressão
2.2.1. Doenças infecciosas (virais, bacterianas, fúngicas)
2.2.2. Doenças hereditárias e metabólicas (anemia falciforme, diabetes mellitus, asplenia congênita)
2.2.3. Doenças neoplásicas (leucemias e linfomas)
2.2.4. Fatores imunossupressores (ciclosporina, corticoide)
2.2.5. Desnutrição e etc.
Diagnóstico de Imunodeficiência
Triagem
Hemograma completo é um dos exames mais informativos e de maior relação custo-benefício.
Contagem de neutrófilos normal: exclui neutropenias congênitas ou adquiridas e defeitos de adesão leucocitária.
Contagem de linfócitos normal para idade: exclui a imunodeficiência grave combinada e defeitos graves de células T.
Plaquetopenia com presença de microplaquetas: sugere síndrome de Wiskott-Aldriclh.
Dosagem de Igs séricas (IgG, IgA e IgM): na suspeita de deficiência de anticorpos.
Imunodeficiência humoral: diminuição de IgG e IgA.
Alergia: aumento de IgE.
Doença autoimune: aumento de IgE.
Infecções: (a) aguda: aumento de IgM; (b) passada/crônica: aumento de IgG.
Quando há suspeita de imunodeficiência humoral, mas os níveis de anticorpos estão normais, deve-se avaliar se estes estão funcionais, através da análise da exposição vacinal e da titulação das iso-hemaglutininas (ver a seguir).
Testes cutâneos de hipersensibilidade tardia (DTH): na suspeita de deficiência da imunidade celular. Método barato e eficiente, porém prevê a sensibilização prévia do paciente aos antígenos testados, pois avalia a sua capacidade de resposta imune celular a partir dos LT de memória. A prova consiste em inocular 0,1 mL da preparação antigênica por via intradérmica. Indivíduos com imunidade celular normal e já sensibilizados para os antígenos testados, têm resultado positivo, formando eritema e nódulo após 24-48 horas, afastando as suspeitas de deficiências graves de células T. Uma boa bateria de antígenos deve incluir: PPD, SK-SD, tétano e candidina, por serem antígenos contra os quais a maioria da população está sensibilizada, tornando-se improvável que um indivíduo normal seja negativo a todos estes antígenos por falta de contato prévio. Em crianças, entretanto, essa chance é muito elevada e, nesse caso, o teste com a Candidina é o que tem maior probabilidade de dar resultado positivo. No Brasil, devido a obrigatoriedade de vacinação precoce com BCG, o teste com o PPD é a melhor escolha.
Na suspeita de imunodeficiência, os exames inicias a serem solicitados são:
Hemograma
Níveis séricos de Imunoglobulinas: IgG, IgA e IgM
Teste cutâneo de Hipersensibilidade Tardia (PPD)
De acordo com a suspeita diagnóstica devem ser solicitados exames mais específicos detalhados a seguir.
I. Avaliação da Imunidade Humoral
As imunodeficiências humorais são as mais frequentes (60%). A história clínica de infecções bacterianas de repetição como pneumonia, meningite, otite média aguda, ou sinusite nos leva a suspeitar de uma deficiência de anticorpo. Ao exame físico é importante que se verifique a presença de órgãos linfoides que podem estar reduzidos ou ausentes nestes pacientes. Em crianças com infecções de repetição, a ausência de adenoide, comprovada pela radiologia de cavum, sugere uma agamaglobulinemia. Na suspeita de imunodeficiência predominantemente humoral os exames iniciais a serem solicitados são:
1. Dosagem das imunoglobulinas séricas (IgA, IgM, IgG)
É o primeiro exame a ser solicitado na suspeita de deficiência de Ac. Por serem proteínas que existem em grande quantidade no nosso organismo, podem ser utilizados os métodos de imunodifusão simples radial, nefelometria ou turbidimetria. Entretanto, alguns serviços, utilizam um método mais sensível como o imunoenzimático (ELISA). Deve-se sempre comparar os resultados encontrados com valores de normalidade para mesma faixa etária.
A IgG é a imunoglobulina de maior concentração plasmática (80%), sendo a classe principal das defesas sorológicas do nosso organismo. A meia-vida plasmática da IgG é de 23 dias.
A IgM é a que alcança valores de adulto mais precocemente. É a classe que predomina na resposta imune primária. A IgM tem potente ação ativadora do complemento, contudo, por causa do seu tamanho (pentâmero), fica restrita ao compartimento intravascular.
A IgA é a que alcança valores de adulto mais tardiamente, por volta dos 8 anos de idade. Nos dois primeiros anos de vida, os níveis de IgA são, geralmente, bem reduzidos, de modo que o diagnóstico só deve ser confirmado após os 4 anos de idade.
De acordo com os níveis de imunoglobulinas séricas, podemos formular as seguintes hipóteses diagnósticas:
IgM e IgG normais e IgA diminuída = deficiência de IgA
IgG e IgA normais e IgM diminuída = deficiência de IgM
IgG e IgA diminuídas e IgM elevada = síndrome de hiper-IgM
IgM, IgG e IgA diminuídas = hipogamaglobulinemia (agamaglobulinemia, hipogamaglobulinemia transitória da infância ou imunodeficiência comum variável).
2. Avaliação funcional das Igs
Teste indicado quando há suspeita clínica de imunodeficiência humoral, mas os níveis séricos de Igs estão normais.
2.1 Pesquisa de Acs ativamente produzidos após exposição vacinal: uma resposta humoral adequada a antígenos vacinais leva à efetiva produção de anticorpos. Esse teste avalia a resposta antígeno-específica para IgG, pela pesquisa de IgG específico produzido contra antígenos vacinais como tétano, sarampo, pólio e rubéola. As técnicas utilizadas são: reação de neutralização, inibição de hemaglutinação e ELISA.
2.2 Determinação do Título de Iso-hemaglutininas (Acs anti-A e anti-B): avalia a resposta antígeno-específica para IgM, pela pesquisa de anticorpos normais contra os antígenos do grupo sanguíneo ABO. Lactentes com mais de 6 meses de idade já são capazes de produzir estes Acs. Esse exame não tem valia para paciente do grupo sanguíneo AB, pois não produzem anti-A nem anti-B. São utilizadas técnicas quantitativas de hemaglutinação.
3. Dosagem das subclasses de IgG
A curva de normalidade para as 4 subclasses deve ser feita por cada laboratório, levando-se em conta os diferentes Acs monoclonais utilizados para suas dosagens. Esse exame tem custo elevado e é menos informativo que a determinação de Acs específicos. Pode ser solicitado quando há quadros infecciosos de repetição com nível de IgG aumentado ou nível de IgG normal acompanhado de IgA diminuído, pois alguma das subclasses de IgG, especialmente IgG2, pode estar diminuída. As técnicas utilizadas são imunodifusão radial simples (Mancini), nefelometria ou turbidimetria, exceto para quantificação de IgG4, cuja concentração sérica está abaixo dos níveis de detecção, sendo necessárias técnicas mais sensíveis como ELISA ou marcação de isótopos radioativos (RIE).
Acs da subclasse IgG1 (60-70%) e IgG3 (4-8%) são, na maioria das vezes, timo-dependentes e direcionados a antígenos proteicos. Atingem níveis semelhantes aos do adulto por volta dos 2 anos de idade.
A IgG2 (14 a 30%) é timo-independente e tem importante participação na resposta humoral contra antígenos de paredes bacterianas (carboidratos e polissacárides). É a que mais demora a alcançar nível de adulto, na adolescência.
Estando os exames acima normais e mantendo-se a suspeita de imunodeficiência humoral pelo quadro de infecções bacterianas de repetição, pode-se solicitar a determinação de anticorpos a antígenos polissacarídeos. Caso a avaliação laboratorial resulte num diagnóstico de hipogamaglobulinemia, deve-se solicitar a determinação dos linfócitos B.
4. Dosagem de anticorpos a antígenos polissacárides
Os antígenos polissacárides estão presentes em bactérias encapsuladas como Haemophilus influenzae tipo b (Hib) e Streptococcus pneumoniae. Como lactentes respondem de forma inadequada a estes antígenos, sem significar deficiência do sistema imune, deve-se avaliar a resposta somente após os 2 anos de idade. É importante que os níveis de anticorpos sejam dosados antes e cerca de 4 a 8 semanas após a imunização. Os valores pré e pós-imunização para cada sorotipo são comparados e verifica-se se houve resposta adequada à bactéria. Atualmente, a vacina anti-Hib conjugada a antígenos proteicos tem sido utilizada de rotina em lactentes, tornando a verificação de produção de anticorpos a antígenos polissacárides inválida aos já imunizados. A avaliação pode ser realizada dosando-se anticorpos pré e pós-imunização pela vacina polissacarídea ao Streptococcus pneumoniae.
5. Avaliação da função dos Linfócitos B (ensaios funcionais dos LB in vitro)
Os linfócitos B, após diferenciação em plasmócitos, são responsáveis pela produção das Igs. Defeitos de maturação podem se manifestar por uma redução acentuada dos níveis de Igs, entretanto, defeitos menores na diferenciação destes linfócitos podem levar à produção em níveis adequados de Igs, mas com função alterada.
5.1 Fenotipagem de linfócitos B (quantificação): cada antígeno leucocitário tem um marcador superficial, chamado CD (cluster of differentiation), que pode ser detectado por um conjunto de anticorpos monoclonais, conjugados à fluoresceína e/ou outro fluorocromo, através de citometria de fluxo. Os Acs monoclonais anti-CD19 e anti-CD20 identificam células pré-B e B. O CD21 é outra importante molécula funcional de LB maduros. Níveis de LB no sangue periférico:
Alto: lactente
Ausentes ou muito reduzidos: portadores de agamaglobulinemia.
Normal ou levemente reduzido: outras deficiências predominantemente humorais.
5.2 Biossíntese de Igs: ativação dos LB por Ag ou mitógeno, podendo-se detectar as Igs policlonais produzidas após 7 dias por técnicas como ELISA e RIE.
5.3 Cultura de linfócitos para ativação mitogênica: o sangue periférico do paciente, colhido com heparina, é purificado por centrifugação em gradiente de Ficoll Hypaque. Células mononucleares (LB, LT e monócitos) são também purificadas. São feitas reações em triplicata, com a adição do mitógeno e posterior adição das células purificadas em cada poço da placa de microtitulação. A cultura é incubada e ocorre a síntese de DNA pelas células ativadas pelo mitógeno, incorporando 3H-Tdr, que permite a contagem de cintilação emitida pelo contador de radiação beta. Os resultados são fornecidos em cpm (contagem por minuto).
Para Avaliação da Imunidade Humoral são feitos os seguintes exames:
Exames Inicias
1.Dosagem de IgG, IgM, IgA séricas
2.Dosagem de Iso-hemaglutininas
3.Dosagem de Acs Vacinais
Exames Complementares
1.Subclasses de IgG
2.Níveis de Acs após vacinas com Ags polissacárides (pneumococos)
3.Quantificação de Linfócitos B (CD19)
II. Avaliação da Imunidade Celular
As imunodeficiências celulares são as mais graves e muitas vezes podem ser acompanhadas de deficiência de anticorpos, sendo denominadas imunodeficiências combinadas. Infecções por fungos ou germes oportunistas são frequentes assim como infecções virais graves. Devido à gravidade do quadro clínico, o diagnóstico deve ser realizado o mais precocemente possível. O tratamento recomendado para algumas dessas imunodeficiências é o transplante de medula óssea. Na suspeita de deficiência da imunidade celular, devem ser realizados os seguintes exames:
1. Hemograma para verificação de número e de morfologia dos linfócitos
Primeiro ano de vida: 4000/mm3, tende a reduzir com a idade.
Idade adulta: 1500/mm3
Lactente com 1000 a 1500 linfócitos/mm3 é portador de linfopenia.
2. Raio-X de tórax para visualização da imagem tímica.
3. Testes cutâneos de hipersensibilidade tardia (DTH)
Método mais barato e eficiente para avaliar a resposta imune celular, útil na avaliação de pacientes com imunodeficiência não diagnosticada, na avaliação e no monitoramento de pacientes com HIV e como auxiliar diagnóstico de doenças bacterianas e fúngicas. DTH é uma resposta inflamatória desencadeada pela presença do antígeno específico, contra o qual o indivíduo já está sensibilizado, caracterizada por um infiltrado de células mononucleares, constituído por linfócitos T de memória, que liberam citocinas recrutadoras de macrófagos. A prova consiste em inocular 0,1 mL da preparação antigênica por via intradérmica. Indivíduos com imunidade celular normal e já sensibilizados com os antígenos testados, têm resultado positivo, que inicia-se como uma reação eritematosa, com a formação de um nódulo que aumenta, progressivamente, até atingir o máximo cerca de 24-48 horas após a inoculação; nenhuma reação costuma ser observada até 5-10 horas. Reações de DTH guardam boa correlação com outras provas de avaliação de imunidade celular. A principal limitação para a interpretação dos resultados negativos é que o teste pressupõe sensibilização prévia e, em crianças, a possibilidade de que ainda não tenha havido contato é muito grande. A utilização de vários antígenos comuns minimiza esse risco. Lactentes com menos de 6 semanas raramente apresentam DTH positiva. A partir dessa idade, podem apresentar resposta, se previamente sensibilizados. Em nosso meio, os antígenos mais utilizados são:
Antígeno do PPD: Derivado Proteico Purificado, obtido de caldo de cultura de Mycobacterium tuberculosis. Após inoculação, resposta imune na pele de indivíduos que já tiveram contato com o bacilo de Kock, seja pela vacina BCG, seja pelo contato com o bacilo (pessoas que já tiveram tuberculose). Pessoas que estão com tuberculose dão uma reação tão forte que há necrose na região do braço aplicada com a injeção. Teste de Mantoux, Tuberculina.
Antígeno Candidina: complexo de metabólitos produzidos pela levedura Candida albicans em meios de cultura sintéticos. Após inoculação, resposta imune na pele de indivíduos já sensibilizados pela levedura.
Antígeno Tetânico: obtido a partir de cultura do bacilo tetânico Clostridium tetani. Aqueles que já contraíram tétano não adquirem anticorpos para evitá-lo novamente; a vacinação é a única forma de proteção: DTP (tríplice bacteriana – difteria, tétano e coqueluche), DTP + Hib (tetravalente – difteria, tétano, coqueluche, meningite e outras infecções causadas pelo Haemophilus influenzae tipo b), dT (duplo adulto – difteria e tétano). Após inoculação, resposta imune na pele de indivíduos que já tenham sido vacinados.
Antígeno Diftérico: obtido a partir de cultura do bacilo Corynebacterium diphtheriae. Aqueles que já contraíram a difteria, em geral, não adquirem imunidade permanente; a vacinação é a forma eficiente de proteção. O esquema básico de vacinação na infância é feito com três doses da vacina contra DTP + Hib. Após inoculação, resposta imune na pele de indivíduos que já tenham sido vacinados.
Antígeno SK-SD (varidase): antígeno estreptoquinase, é uma proteína natural obtida a partir de caldo de cultura de Streptococos beta-hemolíticos. Após inoculação, resposta imune na pele de indivíduos que já tenham sido sensibilizados.
Conceito importante: Anergia Cutânea: ausência de resposta ao desafio com Ag. Está associada a uma série de condições como: infecções sistêmicas agudas ou crônicas, deficiência de linfócito T, doenças autoimunes, desnutrição grave e condições que levam a imunossupressão, como câncer, medicação imunossupressora e doenças renais.
4. Avaliação da função dos Linfócitos T (ensaios funcionais dos LT in vitro)
Útil para caracterização de desordens linfoproliferativas, acompanhamento de infecção por HIV e identificação de possíveis deficiências imunológicas.
4.1 Fenotipagem de LT (quantificação): cada antígeno leucocitário tem um marcador superficial, chamado CD (cluster of differentiation), que pode ser detectado por um conjunto de anticorpos monoclonais conjugados à fluoresceína e/ou outro fluorocromo, através de microscópio de fluorescência ou, preferencialmente, por citometria de fluxo. O grande número de monoclonais gerados contra moléculas dos LT permite identificar subpopulações de células efetoras, além de diferentes estágios de ativação e de maturação. A utilização de 2 fluorocromos, simultaneamente, permite identificar, de uma só vez, até 4 populações celulares: duplo negativas, duplo positivas, positivas apenas para primeiro ou para segundo marcador. O melhor marcador para LT total é o CD3, um complexo molecular associado aos receptores específicos (TCRs), pois é exclusivo de LT e está presente em todas as subpopulações de células T maduras. A caracterização de linfócitos CD3+, geralmente inclui a quantificação das subpopulações CD4+, auxiliar (Th= T helper) e CD8+, citotóxicas (Tc). Essas subpopulações ainda podem ser subdivididas com base em outros marcadores menos utilizados (CD45, CD25, etc.) A quantificação de células NK se faz pela identificação de CD16 e/ou CD56 em células CD3 negativas.
4.2 Cultura de linfócitos para ativação mitogênica: o sangue periférico do paciente, colhido com heparina, é purificado por centrifugação em gradiente de Ficoll Hypaque. Células mononucleares (LB, LT e monócitos) são também purificadas. São feitas reações em triplicata, com a adição do mitógeno e posterior adição das células purificadas em cada poço da placa de microtitulação. O estímulo mais amplamente utilizado é a fitohemaglutinina (PHA), que ativa, inespecificamente, a totalidade das células T. A cultura é incubada e ocorre a síntese de DNA pelas células ativadas pelo mitógeno, incorporando 3H-Tdr, que permite a contagem de cintilação emitida pelo contador de radiação beta. Os resultados são fornecidos em cpm (contagem por minuto). A resposta linfoproliferativa em padrões normais indica que as etapas fundamentais da resposta mediada por LT estão preservadas: blastogênese, células acessórias (monócitos) funcionantes, LT produzindo IL-2 (fator de proliferação de LT) e expressando receptores para IL-2 adequadamente e ausência de fatores inibidores no soro do paciente. No caso de uma resposta linfoproliferativa deficiente, testes adicionais poderão estabelecer qual o ponto responsável por esta resposta insatisfatória. Nas deficiências primárias de células T ou combinadas, o número de células T e a resposta proliferativa encontram-se reduzidos.
Para Avaliação da Imunidade Celular são feitos os seguintes exames:
Exames Inicias
1.Hemograma: morfologia e número de linfócitos
2.Rx de Tórax: imagem tímica
3.Testes Cutâneos de Hipersensibilidade Tardia: PPD, Candidina, SK-SD, Tétano
Exames complementares
1.Quantificação de Linfócitos T: CD3, CD4 e CD8
2.Resposta linfoproliferativa à fitohemaglutinina (PHA)
III. Avaliação de Fagócitos
Neutrófilos são células de vida curta que agem como células efetoras contra muitos tipos de bactérias e fungos. Após opsonização do antígeno pelos anticorpos ou proteínas do sistema complemento, uma quantidade considerável de fagócitos é recrutada ao local de inflamação. A fagocitose induz a um metabolismo oxidativo, "burst" respiratório, sendo produzida uma série de substâncias como peróxido de hidrogênio (H2O2), radicais de hidrogênio (OH-), ânion superóxido(O2-), oxigênio (O2), que juntas são tóxicas, resultando na morte do microrganismo fagocitado. Um defeito no recrutamento dos neutrófilos ou em qualquer uma das etapas de fagocitose ou da capacidade bactericida pode ser responsável pela imunodeficiência. Nas deficiências de fagócitos, infecções supurativas são frequentes: adenites, abscessos cutâneos e pulmonares, osteomielite e etc. O Staphilococcus aureus é agente etiológico frequente nestas infecções. As deficiências de neutrófilos podem ser quantitativas ou qualitativas.
1. Avaliação quantitativa de neutrófilos
1.1 Hemograma: neutropenia (granulócitos abaixo de 1500/mm3). Levar em conta idade e característica racial.
2. Análise qualitativa de neutrófilos
2.1 Teste do NBT (nitroblue tetrazolium) é o mais utilizado para triagem. O NBT é um corante amarelo que passa a azul-escuro após sofrer redução, na geração de superóxido do "burst" respiratório após a fagocitose. As células são incubadas com o NBT e estimuladas com PMA (phorbol myristate acetate), que age como ativador celular. Indivíduos sadios apresentam redução dos neutrófilos >90%, trocando o corante para azul-escuro. Quando não há redução, o corante permanece claro.
2.2 Capacidade Bactericida: a morte do microrganismo intracelular é a etapa final do fagócito frente a um microrganismo. Em algumas imunodeficiências, como Doença Granulomatosa Crônica (CGD - chronic granulomatous disease), Síndrome Chediak-Higashi, deficiência de molécula de adesão (LAD - leukocyte adhesion defect), deficiência de mieloperoxidase, deficiência de glicose 6-fosfato desidrogenase (G6PD), esta etapa está comprometida. A avaliação da capacidade bactericida do fagócito in vitro pode ser feita utilizando-se bactérias ou fungos, cujas cepas opsonizadas são incubadas com os granulócitos do paciente. Após a incubação, é contado o número de bactérias vivas. Na presença de granulócitos normais, cerca de 90% das bactérias estarão mortas após 30 minutos.
2.3 Presença de moléculas de adesão na superfície dos leucócitos: pode ser avaliada utilizando citometria de fluxo. Na deficiência de LAD, há uma redução da expressão do complexo CD18/CD11 devido a um defeito intrínseco na síntese da cadeia beta da molécula CD18.
2.4 Quantificação da mieloperoxidase: enzima responsável pela atividade da peroxidase dos grânulos azurófilos dos neutrófilos e responsáveis pela cor verde do pus. Esta enzima é importante na morte do microrganismo pois gera produtos tóxicos após reagir com o H202 na presença de hálides. Sua deficiência leva à maior susceptibilidade a infecções por staphilococos e por fungos. O diagnóstico pode ser por coloração para peroxidase em sangue periférico.
2.5 Nível sérico de IgE: é importante na suspeita da síndrome da Hiper-IgE. Nesta síndrome, os pacientes apresentam dermatite seborreica e atópica graves, abscessos de repetição, principalmente pelo Staphilococcus aureus.
Para Avaliação dos Fagócitos são feitos os seguintes exames:
Exames Iniciais
1.Hemograma : número e morfologia dos neutrófilos e monócitos
2.Teste do NBT
IV. Avaliação do Sistema Complemento
O sistema complemento (C) é formado por um grupo de proteínas plasmáticas termo-sensíveis que interagem sequencialmente após ativação, mediando processos inflamatórios, realizando a depuração de imunocomplexos, destruindo bactérias por lesão da membrana e neutralizando vírus. Há duas vias de ativação: clássica e alternativa.
As concentrações dos diferentes componentes do C no sangue do recém-nascido a termo atingem valores entre 50% e 70% dos observados em adultos normais, com exceção de C9, cujos níveis são de 16%. Ao final do primeiro ano de idade, todos os componentes atingem valores semelhantes aos de adultos normais. Esses baixos níveis séricos dos componentes do C em relação aos de adultos são parcialmente responsáveis pela atividade opsônica reduzida do soro do recém-nascido, menor capacidade em lisar bactérias Gram-negativas e alguns vírus, menor geração de processo inflamatório e quimiotaxia diminuída de polimorfonucleares e monócitos.
A triagem para avaliação da via clássica do sistema complemento inclui a medida funcional do sistema através da dosagem do complemento hemolítico total, que nos dá uma ideia da integridade funcional da cascata. A dosagem do CH50 mede a atividade hemolítica de diluições séricas do soro do paciente incubado com uma preparação padrão de hemácias de carneiro sensibilizadas. O CH50 é a diluição do soro que produz 50% de lise destas hemácias em condições pré-estabelecidas e é expresso como a recíproca da diluição que dá 50% de hemólise. Deficiência dos fatores B, D ou properdina não afetam o CH50. Desta maneira, deve-se verificar a atividade da via alternativa pela dosagem de AP50. Na presença de CH50 baixo deve-se realizar as dosagens individuais das proteínas para se saber qual é deficiente.
Para Avaliação do Complemento são feitos os seguintes exames:
Exames Iniciais
1.Complemento Hemolítico Total (CH50)
Referências
VAZ, A. J.; TAKEI, K; BUENO, E. C. Imunoensaios: fundamentos e aplicações. Rio de Janeiro: Guanabara Koogan, 2012. 372 p.
PORTAL EDUCAÇÃO. Disponível em
http://www.portaleducacao.com.br/farmacia/artigos/467/testes-intradermicos-tipo-ppd#ixzz3RFh9GtDL, acesso em 09/02/2015.
6 notes
·
View notes
Text
Resposta Imunológica
O sistema imunológico é constituído por uma rede de órgãos, células e moléculas, e tem por finalidade manter a homeostase do organismo, combatendo as agressões em geral.
1. Imunidade Inata
A imunidade inata caracteriza-se pela rápida resposta à agressão, independentemente de estímulo prévio, sendo a primeira linha de defesa do organismo. Seus mecanismos compreendem: (a) barreiras físicas (pele, muco), químicas (pH) e biológicas (microbiota); (b) componentes celulares (fagócitos: neutrófilos, monócitos e macrófagos; células dendríticas e células NK) e (c) componentes moleculares (citocinas, quimiocinas, proteínas do complemento e de fase aguda).
O sistema imune (SI) tem uma capacidade extraordinária para percepção da perda de homeostase do organismo, o que pode ocorrer por invasão de um patógeno ou por lesão tecidual, causada por trauma, infarto e etc. No primeiro caso, estruturas comuns conservadas evolutivamente e essenciais para a sobrevivência dos microrganismos, chamados PAMPs (Padrões Moleculares Associados a Patógenos) são reconhecidos pelo SI. No segundo caso, o tecido lesionado sofre certo grau de necrose, de modo que as células extravasam conteúdo citoplasmático, como proteínas de choque térmico, ATP extracelular e etc, chamados DAMPs (Padrões Moleculares Associados a Dano), também reconhecidos pelo SI. Esse reconhecimento se dá por populações de células da imunidade inata, como macrófagos e células dendríticas, por intermédio dos PRR (Receptores de Reconhecimento de Padrão). Dessa forma, os fagócitos podem fagocitar os corpos estranhos e podem amplificar a resposta imune produzindo citocinas pró-inflamatórias (IL-1, TNF e IL-6). Assim, a imunidade inata lida com infecções e lesões teciduais por indução da inflamação aguda; todas as alterações numa resposta inflamatória são induzidas por citocinas e por moléculas de células dos tecidos. O principal leucócito recrutado do sangue ao sítio afetado é o neutrófilo, mas os monócitos, que se diferenciam em macrófagos nos tecidos, tornam-se cada vez mais proeminentes.
Neutrófilos: têm meia-vida curta e possuem grânulos citoplasmáticos contendo enzimas microbicidas importantes no processo de eliminação dos agentes infecciosos.
Macrófagos: possuem maior capacidade fagocítica e, ao contrário dos neutrófilos, multiplicam-se e sobrevivem por mais tempo no sítio de infecção nos tecidos.
Células dendríticas: caracterizam-se por longas projeções de membrana e, uma vez estimuladas, executam tanto a pinocitose quanto a fagocitose de partículas. Também são importantes na integração da imunidade inata com a adaptativa.
Células NK (Natural Killer): são células circulantes originárias de progenitor linfóide que atuam de maneira diferente dos fagócitos; possuem muitos grânulos contendo mediadores que, ao serem liberados, induzem a morte da célula-alvo por citotoxicidade.
Citocinas: são proteínas que medeiam diversas respostas celulares, como ativação, inibição, diferenciação e crescimento. Existem em grande variedade e atuam no organismo de forma autócrina, parácrina ou endócrina, exercendo suas funções ligando-se a receptores específicos presentes na superfície das células.
Quimiocinas: são proteínas de baixo peso molecular com finalidade exclusiva de recrutar leucócitos para os locais de infecção e tecidos linfóides. Como as citocinas, também atuam via ligação a receptores específicos na superfície celular.
Proteínas do complemento: são plasmáticas e atuam na amplificação da fagocitose e da inflamação, além de eliminarem agentes infecciosos.
Proteínas de fase aguda: sintetizadas no fígado, auxiliam na fagocitose e na ativação do sistema do complemento.
2. Imunidade Adaptativa, mediada por linfócitos T e B
Em contraposição à resposta inata, a resposta imune adaptativa, também chamada de adquirida ou específica, depende da ativação de células especializadas, os linfócitos, e das moléculas solúveis por eles produzidas (Tabela 1). As principais características da resposta adquirida são: especificidade e diversidade de reconhecimento, memória, especialização de resposta, autolimitação e tolerância a componentes do próprio organismo. Embora as principais células envolvidas na resposta imune adquirida sejam os linfócitos, as células apresentadoras de antígenos (APCs) desempenham papel fundamental em sua ativação, apresentando antígenos associados a moléculas do complexo principal de histocompatibilidade (MHC, major histocompatibility complex) para os linfócitos T (LT).
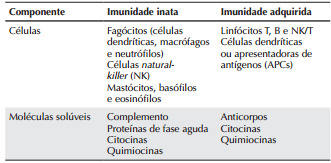
Tabela 1. Células e moléculas solúveis do sistema imunológico. Extraída de Cruvinel, W. M., 2010.
Os principais órgãos responsáveis pela imunidade adaptativa podem ser classificados como órgãos linfoides primários (centrais): fígado fetal, medula óssea e timo; e como órgãos linfoides secundários (periféricos): baço, linfonodos, tecido linfoide associado à mucosa (MALT). As células tronco pluripotentes da medula óssea dão origem às células progenitoras mieloides e linfoides. Os progenitores linfoides, por sua vez, dão origem aos linfócitos T, B e células NK.
IMUNIDADE HUMORAL - LINFÓCITOS B
Os LB são inicialmente produzidos no saco vitelino, posteriormente, durante a vida fetal, no fígado e finalmente na medula óssea. As células que vão se diferenciar em LB permanecem na medula óssea durante sua maturação e os LB maduros deixam a medula e entram na circulação, migrando para os órgãos linfoides secundários. As moléculas responsáveis pelo reconhecimento de antígenos nos LB são as imunoglobulinas de membrana, IgM e IgD, denominados receptores de linfócitos B (BCR) em alguns contextos.
Cada molécula de imunoglobulina (Ig) é constituída por duas cadeias pesadas e duas cadeias leves, ligadas por pontes dissulfeto. Existem cinco tipos de cadeias pesadas denominadas α, γ, δ, ε e μ, que definem as classes de imunoglobulina IgA, IgG, IgD, IgE e IgM, e dois tipos de cadeias leves, κappa (κ) e lambda (λ). A especificidade de ligação ao antígeno é definida pela porção variável (Fab) da molécula, constituída pela união das regiões variáveis das cadeias leve e pesada da imunoglobulina. As propriedades características de cada classe de Ig podem ser vistas na Tabela 2.
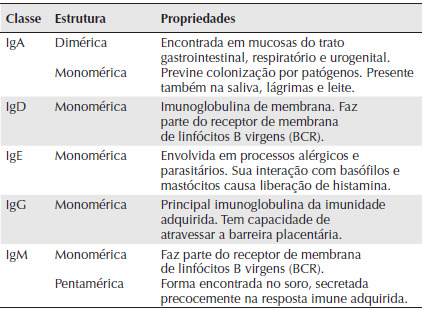
Tabela 2. Características básicas das classes de imunoglobulinas. Extraída de Júnior, D. M., 2010.
O processo combinatório dos diferentes segmentos que compõem as porções variáveis das cadeias pesadas e leves e as diferentes possibilidades de associação entre elas resultam em cerca de 1011 especificidades diferentes de reconhecimento pelas imunoglobulinas. A fim de restringir esse repertório, mecanismos de seleção positiva e negativa atuam durante a maturação dos LB. Na seleção positiva, os LB imaturos expressando moléculas funcionais de Ig de membrana recebem sinais de sobrevivência para prosseguir a maturação. No processo de seleção negativa, os LB imaturos, ainda na medula óssea, que reconhecem antígenos próprios com alta afinidade (auto reativos) sofrem apoptose ou entram em um processo denominado edição de receptor, visando garantir que os LB circulantes sejam tolerantes aos Ag próprios.
ATIVAÇÃO DOS LINFÓCITOS B
Os LB são responsáveis pela imunidade humoral que se caracteriza pela produção e liberação de anticorpos capazes de neutralizar ou destruir os antígenos (Ag) contra os quais foram gerados. Para isso, é preciso a ativação dos LB, que se dá pela ligação do receptor de LB (BCR) a um epítopo antigênico (reconhecimento). O BCR é constituído, além da imunoglobulina de membrana, por duas cadeias peptídicas, Igα e Igβ, que ativam fatores de transcrição de genes envolvidos na proliferação e diferenciação dos LB. Além disso, proteínas do complemento fornecem sinais secundários para ativação por meio do receptor para o fragmento C3d, denominado CR2 ou CD21, expresso na superfície dos LB. O CD21 forma um complexo com outras duas proteínas de membrana, CD19 e CD81, permitindo o reconhecimento simultâneo do C3d e do antígeno pelo BCR. Esta ligação promove o início da cascata de sinalização de ambos os receptores, gerando uma resposta muito maior se comparada à resposta do antígeno não ligado à molécula C3d. A possibilidade da ligação C3d/CR2 atuar como o segundo sinal para a ativação dos LB garante o desencadeamento da resposta frente a microrganismos e antígenos que ativam o complemento. Esse é também um mecanismo de amplificação da resposta imune humoral, uma vez que anticorpos capazes de ativar o complemento vão resultar em maior estímulo dos LB.
Após os LB interiorizarem e processarem o Ag ligado ao receptor de superfície (BCR), funcionam também como células apresentadoras de antígeno. Os peptídeos gerados pelo processamento são expressos na membrana dos LB ligados às moléculas do complexo maior de histocompatibilidade (MHC) classe II, para apresentação aos LTCD4+ (auxiliares). A interação do MHC classe II com o receptor de LT (TCR) leva os LT auxiliares à expansão clonal, produzindo citocinas que estimulam a proliferação e diferenciação dos LB. A resposta dos LB a antígenos peptídicos requer a ajuda dos LT auxiliares e esses antígenos são, por isso, denominados “antígenos T dependentes”. Muitos antígenos não proteicos, com epítopos repetitivos, não necessitam da cooperação dos LT e são denominados “antígenos T independentes”.
CARACTERÍSTICAS DA RESPOSTA T DEPENDENTE
A resposta humoral frente a Ag proteicos requer o reconhecimento do antígeno pelos LT auxiliares e sua cooperação com os LB antígeno-específicos, estimulando a expansão clonal dos LB, a mudança de classe, a maturação de afinidade e a diferenciação em LB de memória.
A etapa de diferenciação caracteriza-se por alterações significativas na morfologia dos LB e por troca da porção constante da cadeia pesada de IgM ou IgD para IgG, IgA ou IgE, processo conhecido como mudança de classe. Neste processo as porções variáveis das cadeias pesada e leve permanecem as mesmas e consequentemente a especificidade antigênica do anticorpo não é alterada, mas a resposta imune torna-se mais diversificada, uma vez que as diferentes classes de Ig apresentam diferentes características funcionais.
No início da resposta, há Ag suficiente para interagir com LB tanto de alta quanto de baixa afinidade e os anticorpos produzidos são heterogêneos. No decorrer da resposta, quantidades maiores de anticorpos se ligam ao Ag diminuindo sua disponibilidade. Os LB com Ig de maior afinidade são preferencialmente estimulados, sendo este processo denominado maturação da afinidade. A seleção positiva garante a sobrevivência seletiva de LB produtores de anticorpos de afinidade progressivamente maior.
Pelo fato de que persistem LB de memória após uma exposição a antígenos T dependentes, os anticorpos produzidos numa resposta secundária apresentam afinidade média mais alta que os produzidos na primária. Esse processo é importante na eliminação de antígenos persistentes ou recorrentes
Resposta Primária: o primeiro contato com um antígeno, por exposição natural ou vacinação, leva à ativação de LB virgens, que se diferenciam em plasmócitos produtores de anticorpos e em células de memória, resultando na produção de anticorpos específicos contra o antígeno indutor. Após o início da resposta, observa-se uma fase de aumento exponencial dos níveis de anticorpos, seguida por uma fase platô e uma fase de declínio, na qual ocorre uma diminuição progressiva dos anticorpos específicos circulantes.
Resposta Secundária: ao entrar em contato com o antígeno pela segunda vez, já existe uma população de LB capazes de reconhecer esse antígeno devido à expansão clonal e células de memória geradas na resposta primária. A resposta secundária difere da primária nos seguintes aspectos: a dose de antígeno necessária para induzir a resposta é menor; a fase de latência é mais curta e a fase exponencial é mais acentuada; a produção de anticorpos é mais rápida e são atingidos níveis mais elevados; a fase de platô é alcançada mais rapidamente e é mais duradoura e a fase de declínio é mais lenta e persistente.
Nos dois tipos de resposta, primária e secundária, há a produção dos isótipos IgM e IgG, porém, na resposta primária IgM é a principal Ig e a produção de IgG é menor e mais tardia. Na resposta secundária, a IgG é a imunoglobulina predominante. Nas duas respostas, a concentração de IgM sérica diminui rapidamente de maneira que, após uma ou duas semanas, observa-se queda acentuada enquanto a produção de IgG é persistente.
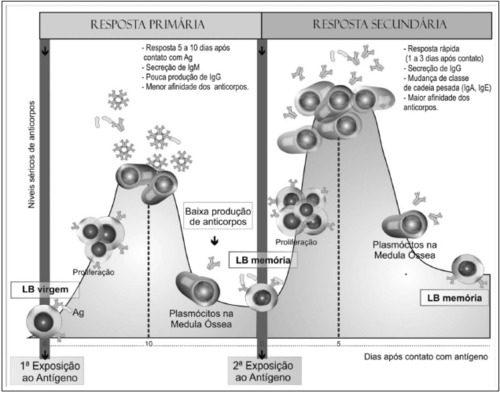
Figura 1. Visão esquemática das fases primária e secundária da resposta imune adaptativa humoral. As células B virgens nos tecidos linfoides periféricos são ativadas a partir do contato com o antígeno, proliferam e diferenciam-se em células secretoras de anticorpos e células B de memória. A resposta secundária é mais rápida e ocorre a partir da ativação das células B de memória promovendo a produção de maiores quantidades de anticorpos. Extraída de Júnior, D. M., 2010.
CARACTERÍSTICAS DA RESPOSTA T INDEPENDENTE
Antígenos T independentes podem estimular a produção de anticorpos na ausência total ou relativa de LT. Esses antígenos são usualmente moléculas não proteicas, poliméricas, que estimulam a produção de Ig de baixa afinidade pertencentes, na sua maioria, à classe IgM. Como, geralmente, não há ativação de LT, não serão geradas as citocinas necessárias para a mudança de classe, maturação de afinidade ou formação de LB de memória. Raramente na resposta a antígenos T independentes ocorre mudança para outros isótipos. Um exemplo da importância da resposta a antígenos T independentes é a imunidade humoral frente a polissacarídeos bacterianos, um mecanismo decisivo na defesa do hospedeiro contra infecções por bactérias encapsuladas. Por essa razão, indivíduos com deficiências congênitas ou adquiridas que prejudiquem a resposta humoral são especialmente suscetíveis a infecções, muitas vezes fatais, por bactérias encapsuladas.
IMUNIDADE CELULAR - LINFÓCITOS T
As células que vão se diferenciar em linfócitos T (LT), células pré-T, deixam a medula óssea e migram para o timo, onde ocorre todo o processo de seleção e maturação. Apenas os linfócitos T maduros deixam o timo e caem na circulação. O processo de maturação dos LT envolve a expressão de um receptor de células T (TCR) funcional e dos co-receptores CD4 e/ou CD8. Os LT só reconhecem antígenos processados, apresentados por moléculas de MHC na superfície de uma célula apresentadora de antígeno (APC). O TCR é expresso na membrana dos LT em associação com um complexo denominado CD3, composto por cinco diferentes proteínas da família das imunoglobulinas. O TCR é responsável pelo reconhecimento do complexo peptídeo-molécula de MHC, e o CD3, pela sinalização celular subsequente.
O TCR é formado por duas cadeias peptídicas da superfamília das imunoglobulinas, com uma região variável e uma região constante, formadas a partir de segmentos gênicos que durante a maturação dos LT sofrem recombinação de forma semelhante à do BCR. A diversidade de repertório potencial dos LT é algo em torno de 1016.
O processo de maturação dos LT ocorre em etapas sequenciais. Os timócitos, ou linfócitos imaturos, começam a expressar baixos níveis de CD4 e CD8 na superfície, sendo, portanto, duplo-positivos. Nesta fase, migram em direção à medula tímica e entram em contato com Ag próprios. Apenas aqueles que se ligam ao complexo MHC/Ag com afinidade adequada recebem estímulo para sobreviver (seleção positiva). Os timócitos cujo TCR não apresenta afinidade pelo MHC próprio sofrem apoptose pela falta de estímulo. A interação com moléculas MHC de classe I ou II determina a diferenciação do timócito em LT CD8+ ou CD4+, respectivamente. Continuando a maturação, os timócitos que sobreviveram à seleção positiva e expressam apenas CD4 ou CD8 entram em contato na medula com células dendríticas e macrófagos, células apresentadoras de antígenos extremamente eficientes, que apresentam Ag próprios associados ao MHC. Os timócitos imaturos que interagem com muita afinidade com esses complexos morrem por apoptose (seleção negativa). As células que sobrevivem tornam-se LT maduros, prontos para deixar o timo e exercer suas funções na periferia. Este processo visa garantir que os LT circulantes sejam tolerantes aos Ag próprios, mas capazes de reconhecer Ag estranhos ao organismo quando apresentados pelo MHC próprio. Entretanto, os mecanismos centrais de tolerância não são absolutos e LT autorreativos podem ser encontrados na periferia. Entre outros mecanismos de regulação periférica, destacam-se diferentes populações de LT reguladores que atuam na periferia impedindo o desenvolvimento de autoimunidade.
LT efetores: os dois principais subtipos de LT efetores são os auxiliares (Th) (CD4) e os citotóxicos (CD8), ambos apresentam receptor TCRab. Ambos os subtipos apresentam papel muito importante no controle de patógenos intracelulares.
LT CD4 Auxiliares (Th): reconhecem antígenos apresentados por moléculas MHC de classe II. São responsáveis por orquestrar outras células da resposta imune na erradicação patógenos e são importantes na ativação dos LB, macrófagos ou mesmo LT CD8. São subdivididos funcionalmente pelo padrão de citocinas que produzem. Durante o estímulo fornecido por uma APC, um linfócito precursor Th0 pode se tornar um linfócito Th1, Th2 ou Th17, na dependência das citocinas presentes. Embora morfologicamente indistinguíveis essas células apresentam distintos padrões de citocinas secretadas e diferentes respostas efetoras (Figura 2).
LT CD8 (citotóxicos): reconhecem antígenos intracitoplasmáticos apresentados por moléculas MHC de classe I, que são expressas por praticamente todas as células nucleadas. Estão envolvidos principalmente nas respostas antivirais e possuem também atividade antitumoral. Após adesão às células alvo apresentando um antígeno associado ao MHC e coestímulo adequado, os LT CD8 proliferam e, em um encontro subsequente, podem eliminar por citotoxicidade qualquer célula que apresente esse antígeno especifico, independente da presença de moléculas coestimulatórias. Induzem a apoptose na célula alvo pela ação de perforinas e granzimas e também podem levar à apoptose pela expressão do receptor Fas L (CD95) que interage com a molécula Faz nas células alvo.
LT γδ: uma pequena população de LT periféricos possui TCR com diversidade limitada, composto por cadeias γδ. Essas células são comumente encontradas nas primeiras linhas de defesa do organismo, como as barreiras mucosas e a pele, onde atuam como verdadeiras sentinelas de reconhecimento de padrões moleculares, reconhecendo e apresentando antígenos, respondendo a eles e contribuindo para ativação e proliferação de células do sistema imune. Essas células diferem dos LT αβ, pois seu TCR pode reconhecer antígenos mesmo na ausência de apresentação pela molécula de MHC. Apresentam também memória imunológica, respondendo mais vigorosamente em um segundo encontro antigênico e exercem suas funções efetoras de maneiras variadas, podendo apresentar citotoxicidade, apresentar função auxiliadora liberando citocinas, atuar como APCs apresentando antígenos aos LTαβ, ativar células dendríticas e LB, ampliando assim tanto a resposta imune celular como humoral. Os LTγδ podem ser incluídos tanto na imunidade inata quanto na adaptativa, sugerindo que essas células representam uma forma primitiva e conservada de imunidade.
LT Reguladores: importantes na manutenção da autotolerância imunológica e no controle das respostas autoimunes. As células com função imunorreguladora apresentam como característica básica a capacidade de produção de citocinas imunossupressoras, como IL-4, IL-10 e TGF-β.
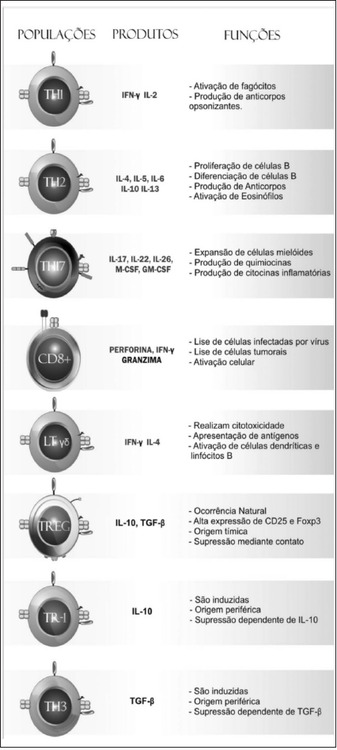
Figura 2. Características gerais das células T com destaque para os LT auxiliares (subtipos TH1 e TH2), células TH17, LT citolíticos, LTγδ e células T reguladoras naturais (TREGs) e induzidas (TR-1 e Th3). Extraída de Júnior, D. M., 2010.
Células NK/T: praticamente todas as células que expressam TCRαβ são restritas ao MHC e expressam co-receptores CD4 ou CD8. Uma pequena população de LT expressa marcadores encontrados em células NK e são conhecidas como células NK/T. Estas células expressam TCR com cadeias α de diversidade limitada, que reconhece lipídeos ligados a moléculas não-polimórficas, denominadas CD1 e semelhantes ao MHC da classe I. As células NK/T parecem surgir do mesmo precursor que origina LT convencionais, mas são selecionadas positivamente após interações de alta avidez com glicolipídeos associados a moléculas CD1d. Apesar do repertório limitado, as células NK/T apresentam duas estratégias diferentes no reconhecimento de patógenos. A primeira, observada no reconhecimento de bactérias Gram negativas, ocorre pela sinalização de receptores do tipo Toll (TLR) pelo LPS. A segunda ocorre pelo reconhecimento específico de glicosilceramidas presentes na parede celular bacteriana, apresentadas por CD1d, garantindo o reconhecimento de patógenos que não apresentam ligantes para TLRs em sua parede celular. Devido ao reconhecimento de glicolipídios conservados, essas células estão envolvidas em respostas alérgicas, inflamatórias, tumorais e na autoimunidade, além de participarem da regulação da resposta imune.
APRESENTAÇÃO DE ANTÍGENOS E ATIVAÇÃO DE LT
A apresentação de antígenos aos LT inicia-se com o processamento antigênico pelas APCs, que consiste na captura do antígeno, sua degradação proteolítica a fragmentos menores, transporte e acomodação nas moléculas do MHC e transposição do complexo MHC-peptídeo para a superfície celular para reconhecimento pelo TCR. Normalmente os antígenos exógenos, fagocitados ou endocitados, são acomodados em moléculas de MHC classe II, que interagem com o TCR e o co-receptor CD4 na superfície celular dos LT, enquanto os antígenos intracelulares são convertidos em peptídeos e associados às moléculas de MHC I, que interagem com o TCR e o co-receptor CD8 na superfície dos LT. Para que ocorra a ativação dos LT, após o reconhecimento do peptídeo pelo TCR, há necessidade de um segundo sinal, que é mediado pela interação de várias outras moléculas coestimulatórias presentes na superfície do LT e da APC. Por sua importância na regulação da resposta imune, destacamos as moléculas coestimuladoras participantes da interação CD28-CD80 ou CD28-CD86, que resulta em sinais estimuladores, e da interação CD28-CTLA4, que promove sinalização inibitória.
Referências
Pagliarone, A., C. e Moreira, E. A. Imunidade Inata. Disponível em iba.byte2b.com.br/sites/default/files/01_imunidade_inata.doc, acesso em 04/02/2015.
Cruvinel, W. M.; Júnior, D. M.; Araújo, J. A. P.; et al. Sistema Imunitário – Parte I: Fundamentos da imunidade inata com ênfase nos mecanismos moleculares e celulares da resposta inflamatória. Rev Bras Reumatol 2010;50(4):434-61. Disponível em http://www.scielo.br/pdf/rbr/v50n4/v50n4a08.pdf, acesso em 04/02/2015.
Júnior, D. M.; Araújo, J. A. P.; Catelan, T., T., T.; et al. Sistema Imunitário – Parte II: Fundamentos da resposta imunológica mediada por linfócitos T e B. Rev Bras Reumatol 2010;50(5):552-80. Disponível em http://www.scielo.br/pdf/rbr/v50n5/v50n5a08.pdf, acesso em 04/02/2015.
18 notes
·
View notes
Text
Análise Fecal
Exames fecais de rotina incluem as análises (1) macroscópica, (2)microscópica e (3) bioquímica.
A detecção e a identificação de bactérias patogênicas e de parasitassão de igual valor diagnóstico, porém não são discutidas nesse resumo.
Diarreia: aumento de pesodiário das fezes acima de 200 g, com maior volume líquido e frequência de maisde três vezes por dia. Os principais mecanismos da diarreia são secretores,osmóticos e alteração de motilidade. Os testes de laboratório para diferenciaresses mecanismos são eletrólitos fecais (sódio e potássio), osmolaridade fecale pH das fezes. A osmolaridade fecal total é próxima à osmolaridade do soro(290 mOsm/Kg). Os resultados de sódio e potássio fecais são utilizados para calcular o gap osmótico fecal:
Gap osmótico = 290 – [2 (sódio fecal + potássio fecal)]
a) Diarreia Secretora: infecções bacterianas, virais e protozoárias produzem aumento da secreção de água e de eletrólitos, que superará a capacidade absortiva do intestino grosso (diarreia secretora). Organismos produtores de enterotoxinas, como Escherichia coli, Salmonella, Shigella, Vibrio cholerae, Campylobacter, Clostridium, Staphylococcus, protozoários e parasitas como o Cryptosporium podem estimular a secreção de água e de eletrólitos. Outras causas da diarreia secretora são drogas, laxantes, hormônios, doenças inflamatórias intestinais (Doença de Crohn, colite ulcerativa, colite linfocítica, diverticulite), doenças endócrinas (hipertireoidismo, Síndrome de Zollinger-Ellison, vipoma), neoplasias, doenças do colágeno vascular.
Gap osmótico < 50 mOsm/Kg e eletrólitos aumentados.
b) Diarreia Osmótica: má-digestão ou má-absorção dos alimentos provocam maior quantidade de material fecal para o intestino grosso, resultando na retenção de água e de eletrólitos (diarreia osmótica) que, por sua vez, resulta em excesso de fezes aquosas. A presença de soluto não absorvível aumenta a osmolalidade fecal e a concentração de eletrólitos é menor, resultando em aumento do gap osmótico. As causas da diarreia osmótica incluem deficiência de dissacaridase (intolerância à lactose), laxantes, antiácidos com magnésio, amebíase e antibióticos.
Gap osmótico > 50 mOsm/Kg e eletrólitos insignificantes. Fluido fecal com pH < 5,6 indica má-absorção de açúcares, que causa a diarreia osmótica.
c) Motilidade Alterada: condições de hipermotilidade e de constipação intestinal. Pode ser vista na síndrome do intestino irritável (SII), perturbação na qual nervos e músculos do intestino estão supersensíveis, causando cólica, edema, flatulência, diarreia e constipação. A SII pode ser desencadeada por alimentos, produtos químicos, estresse emocional e exercício. Rápido esvaziamento gástrico (REG), ou síndrome de dumping, descreve a hipermotilidade do estômago e o encurtamento do tempo médio de esvaziamento, o que faz com que o intestino delgado encha muito rapidamente com alimento não digerido pelo estômago, marca da síndrome de dumping precoce (SDP). Os sintomas da SDP começam entre 10 e 30 minutos após a ingestão de refeição e incluem náuseas, vômitos, edema, cólicas, diarreia, tonturas e fadiga. As principais causas da síndrome de dumping incluem gastrectomia, cirurgia de bypass gástrico, pós-vagotomia, úlcera duodenal e diabetes mellitus.
Esteatorreia: o aumento de gordura nas fezes pode ser resultado de doenças pancreáticas, como fibrose cística, pancreatite crônica e carcinoma, que diminuem a produção de enzimas pancreáticas (insuficiência pancreática), da ausência de sais biliares que auxiliam a lipase pancreática na degradação e reabsorção de triglicérides e de doenças do intestino delgado que causam má-absorção. A esteatorreia pode estar presente em ambas condições, má-absorção e má-digestão, e pode ser diferenciada pelo teste da D-xilose, um açúcar não digerido, mas absorvido para estar presente na urina. Se a D-xilose urinária é baixa, a esteatorreia pode indicar má-absorção. As causas de má-absorção incluem supercrescimento bacteriano, ressecção intestinal, doença celíaca, sprue tropical, linfoma, infestação por Giardia lamblia, Doença de Crohn e isquemia intestinal. O teste da D-xilose normal indica pancreatite.
Coleta: as instruções detalhadas e os recipientes adequados devem ser fornecidos. Os pacientes devem ser instruídos a coletar a amostra em um recipiente limpo, como uma comadre ou um recipiente descartável, e transferi-la para o recipiente fornecido pelo laboratório. A amostra não deve ser contaminada com urina ou água do vaso sanitário. Para testes qualitativos e exames microscópicos são adequadas amostras aleatórias, normalmente, coletadas em recipientes plástico ou de vidro com tampa de rosca, semelhantes aos utilizados para amostras de urina. Para testes quantitativos são necessárias amostras coletadas em tempos determinados, devido à variabilidade dos hábitos intestinais, sendo a amostra mais representativa a de três dias. Ao abrir qualquer frasco que contenha amostra fecal, deve-se tomar cuidado para liberar lentamente o gás que se acumulou dentro do recipiente.
1. Triagem Macroscópica
1.1. Cor
Cor normal: marrom. Após a passagem através do ducto biliar para o intestino delgado, a bilirrubina conjugada, formada na degradação da hemoglobina, é convertida em urobilinogênio e estercobilinogênio pelas bactérias intestinais. A oxidação intestinal de estercobilinogênio para urobilina dá a coloração marrom às fezes.
Fezes descoradas (amarela, branca, cinza): obstrução do ducto biliar ou procedimentos diagnósticos que utilizam sulfato de bário.
Fezes vermelho-escuro ao preto: liberação de sangue pelo trato gastrointestinal superior (esôfago, estômago ou duodeno). O sangue originado nestas porções leva aproximadamente três dias para aparecer nas fezes, de modo que a degradação da hemoglobina escurece as fezes. Ainda pode ser devido à ingestão de ferro, carvão ou bismuto (antiácidos).
Fezes vermelhas: liberação de sangue pelo trato gastrointestinal inferior. A liberação por esta porção requer menos tempo para aparecer nas fezes e conserva a cor vermelha original. Ainda pode ser devido à ingestão de alimentos como a beterraba.
Fezes verdes: pacientes que tomam antibióticos orais, devido à oxidação da bilirrubina fecal para biliverdina, ou ingestão de grande quantidade de vegetais verdes ou alimentos coloridos.
1.2. Aspecto
Consistência aquosa: diarreia aquosa
Fezes pequenas e duras: constipação
Fezes delgadas em fita: obstrução da passagem normal do material fecal pelo intestino.
Fezes volumosas, espumosas e com mau cheiro: obstrução do ducto biliar, doença pancreática, esteatorreia. As fezes podem parecer gordurosas e flutuar.
Fezes com muco: inflamação ou irritação intestinal, podendo ser causadas por colite patológica ou esforço excessivo durante a eliminação.
Fezes com muco e laivos de sangue: danos à parede intestinal, possivelmente causados por bactérias, disenteria ou neoplasia. A presença de muco deve ser comunicada.
2. Exame Microscópico de Fezes
2.1. Leucócitos Fecais
Leucócitos, principalmente neutrófilos, são vistos nas fezes em condições que afetam a mucosa intestinal, como colite ulcerosa e disenteria bacteriana. A triagem microscópica é feita como teste preliminar para determinar se a diarreia é causada por bactérias patogênicas invasoras, como E. coli enteroinvasiva, Salmonella, Shigella, Yersinia, Campylobacter. As bactérias que causam diarreia por produção de toxina, como Staphylococus aureus e Vibrio spp., vírus e parasitas, normalmente, não causam o aparecimento de leucócitos fecais. As amostras podem ser examinadas como preparações a fresco, coradas com azul de metileno, ou com esfregaços secos, corados com Wright ou Gram. A coloração com azul de metileno é um processo mais rápido, porém mais difícil de interpretar. As preparações secas coradas com Wright ou Gram fornecem lâminas permanentes. Uma vantagem adicional do Gram é a observação de bactérias gram-positivas ou gram-negativas. Todas as preparações em lâminas devem ser realizadas em amostras frescas. As amostras podem, ainda, ser examinadas pelo teste de aglutinação de látex lactoferrina. A lactoferrina é um componente dos grânulos dos granulócitos, de modo que sua presença é indicativa de uma invasão por bactérias patogênicas. Este teste permanece sensível em amostras refrigeradas e congeladas.
Procedimento de Coloração com Azul de Metileno para Leucócitos Fecais
Coloque uma gota de muco ou fezes líquidas em uma lâmina.
Acrescente duas gotas de azul de metileno Loffler.
Misture com um bastão aplicador de madeira.
Deixe repousar por 2 a 3 minutos.
Examine para neutrófilos em grande aumento.
2.2. Fibras Musculares
A presença de fibras musculares estriadas não digeridas pode ser útil no diagnóstico e no acompanhamento de pacientes com insuficiência pancreática, como nos casos de fibrose cística. Também pode ser observada na obstrução biliar e em fístulas gastrocólicas. O exame microscópico das fibras é frequentemente solicitado em conjunto com o exame microscópico de gorduras fecais. As lâminas são preparadas pela emulsificação de uma pequena quantidade de fezes com eosina alcoólica a 10%, o que reforça as estrias da fibra muscular. Toda a lâmina é analisada por 5 minutos e o número de fibras coradas com vermelho com estrias bem preservadas é contado. Deve-se cuidar para classificar corretamente as fibras observadas: as não digeridas têm estrias visíveis, tanto no sentido vertical quanto no horizontal; parcialmente digeridas apresentam estrias em apenas uma direção e as digeridas não apresentam estrias visíveis. Apenas as estrias NÃO digeridas são contadas e a presença de mais de dez é relatada como aumento.
Procedimento para Fibra Muscular
Emulsione uma pequena quantidade de fezes com duas gotas de eosina a 10% em álcool.
Coloque uma lamínula e deixe repousar por 3 minutos.
Examine sob grande aumento por 5 minutos.
Conte o número de fibras não digeridas.
2.3. Gorduras Fecais, Qualitativo
Amostras de casos suspeitos de esteatorreia podem ser triadas microscopicamente para o excesso de gordura nas fezes. O procedimento também pode ser utilizado para monitorar pacientes em tratamento para doenças de má-absorção. Os lipídeos incluídos no exame são gorduras neutras (triglicerídeos), sais de ácidos graxos (sabões), ácidos graxos e colesterol, visualizados pela coloração com Sudan III (mais utilizado), Sudan IV ou óleo vermelho O. O processo de coloração consiste em duas partes, a coloração de gorduras neutras e a coloração de gordura hidrolisada. As gorduras neutras são facilmente coradas por Sudan III, aparecendo como grandes gotas vermelho-alaranjadas próximas à borda da lamínula. A visualização de mais de 60 gotas por campo de grande aumento pode indicar esteatorreia; no entanto, a coloração de gordura hidrolisada (que representa o conteúdo total de gordura) proporciona melhor indicação. Sabões e ácidos graxos não coram diretamente com Sudan III. Uma segunda lâmina é examinada após a amostra ser misturada com ácido acético e aquecida. As gotículas coradas apresentam não só os ácidos graxos livres, mas também os ácidos graxos produzidos pela hidrólise do sabão e das gorduras neutras. Em exame de lâmina de gordura hidrolisada, tanto o número quanto o tamanho das gotículas devem ser considerados. Amostras normais podem conter até cerca de 100 gotículas pequenas, com menos de 4 mm, por campo de grande aumento. O mesmo número de gotas com 1 a 8 mm é considerado ligeiramente aumentado e com 6 a 75 mm é aumentado. O colesterol é corado pelo Sudan III após o aquecimento e, quando a amostra esfria, forma cristais identificados microscopicamente.
Procedimento de Coloração de Gorduras Neutras
Homogeneíze uma parte de fezes com duas partes de água.
Misture as fezes emulsificadas com uma gota de álcool etílico a 95% em uma lâmina.
Adicione duas gotas de Sudan III saturado em etanol a 95%.
Misture e coloque a lamínula.
Examine sob grande aumento.
Conte as gotículas laranja por campo de grande aumento.
3. Testes Bioquímicos nas Fezes
3.1. Sangue Oculto (PSO)
Qualquer sangramento acima de 2,5 mL/150g de fezes é considerado patológico e o pode estar presente sem sinais visíveis com essa quantidade de sangue, fazendo-se necessário PSO. Utilizado para testar casos suspeitos de doença gastrointestinal e, atualmente, como triagem para a detecção precoce do câncer colorretal. A realização anual do teste tem alto valor preditivo positivo para detecção de câncer colorretal nas fases iniciais e é recomendada, em especial, para pessoas com mais de 50 anos de idade. Os testes de triagem para sangue oculto mais encontrados baseiam-se na detecção da atividade de pseudoperoxidase de hemoglobina. A reação utiliza a atividade de pseudoperoxidase da hemoglobina, reagindo com peróxido de hidrogênio para oxidar um composto incolor que se torna um composto colorido. Vários cromógenos indicadores têm sido utilizados, sendo a cola de guáiaco o preferido na rotina. Kits diagnósticos comerciais estão disponíveis, contendo um papel-filtro impregnado com guáiaco, ao qual a amostra fecal e o peróxido de hidrogênio são adicionados. Duas ou três áreas de papel-filtro são fornecidas para a aplicação de material fecal, retirado de diferentes áreas das fezes, e de controles positivos e negativos. A adição de peróxido de hidrogênio na parte de trás do papel-filtro, que contém as fezes, produz a cor azul com o reagente guáiaco quando a atividade de pseudoperoxidase está presente. Amostras aplicadas ao papel-filtro no laboratório devem ser deixadas secar antes do ensaio e devem ser testadas dentro de seis dias após a coleta. Duas amostras provenientes de três diferentes fezes devem ser testadas antes que um resultado negativo seja estabelecido. Os pacientes devem ser instruídos a evitar ingerir durantes três dias antes da coleta: carnes vermelhas, raiz forte, melões, brócolis cru, couve-flor, rabanetes e nabos, por risco de resultado falso-positivo devido à pseudoperoxidase da dieta; e vitamina C, por risco de resultado falso-negativo devido à interferência na técnica. Além disso, a ingestão de aspirina e outros AINEs devem ser evitados durante sete dias antes da coleta por risco de irritação gastrointestinal. Outros métodos, mais sensíveis e específicos têm sido desenvolvidos. O Hemoquant é um teste fluorimétrico para hemoglobina e porfirina. À medida que a hemoglobina progride através do trato gastrointestinal, a ação bacteriana a degrada a porfirina, que o teste com guáiaco pode não detectar. O teste imunoquímico para sangue oculto nas fezes (iSOF), Hemoccult ICT, é específico para a porção globina da hemoglobina humana, utilizando anticorpos anti-hemoglobina humana, não necessitando restrições de dieta ou de drogas.
3.2. Teste de Gordura Fecal Quantitativos
É utilizado como teste confirmatório para esteatorreia. A análise quantitativa fecal requer a coleta de, pelo menos, uma amostra de três dias. O paciente deve manter ingestão de gordura controlada (100g/dia), antes e durante o período de coleta. Latas de tinta são excelentes recipientes de coleta porque a amostra deve ser homogeneizada antes da análise. A refrigeração da amostra impede qualquer degradação bacteriana. O método utilizado rotineiramente e padrão-ouro é a titulação de Van de Kamer. Lipídeos fecais são convertidos em ácidos graxos e titulados para um pH neutro com hidróxido de sódio. Os valores normais do teor de gordura, baseados na ingestão de 100 g/dia, são de 1 a 6 g/dia ou um coeficiente de retenção de gordura de, pelo menos, 95%. Alternativamente, o esteatócrito ácido é um teste rápido, mais conveniente que coleta de fezes por 72 horas, confiável para controlar a resposta do paciente ao tratamento e para triar a população pediátrica para esteatorreia. A espectroscopia de refletância próxima ao infravermelho (Nira) é um procedimento rápido que requer menor manipulação das fezes. Deve haver coleta de 48 a 72 horas para excluir variabilidade diária. O resultado baseia-se na medição computadorizada, calculado a partir da calibração derivada de amostras conhecidas. A técnica quantifica água, gordura e nitrogênio, em gramas por dia.
3.3. Enzimas Fecais
As enzimas fornecidas para o trato gastrointestinal pelo pâncreas são essenciais para a digestão de carboidratos, proteínas e gorduras da dieta. Uma redução na produção dessas enzimas (insuficiência pancreática) está associada a perturbações, como pancreatite crônica e fibrose cística. Ocorre esteatorreia e existe a presença de alimentos não digeridos nas fezes. A análise é, principalmente, das enzimas proteolíticas tripsina, quimiotripsina e elastase I. A ausência da tripsina tem sido triada pela exposição de chapas de raio X às fezes emulsificadas em água. Quando a tripsina está presente nas fezes, digere a gelatina sobre a chapa, deixando uma área clara. A incapacidade de digerir a gelatina indica deficiência de tripsina. Esta técnica é insensível e detecta apenas casos graves de insuficiência pancreática. A quimiotripsina também é capaz de hidrolisar a gelatina, mas é mais frequentemente medida por métodos espectrofotométricos. É mais resistente à degradação e é um indicador mais sensível de casos menos graves de insuficiência pancreática. A Elastase I fecal é específica do pâncreas, é altamente resistente à degradação e a sua concentração é alta, cerca de cinco vezes maior que no suco pancreático. Requer apenas uma única amostra de fezes. Não é afetada por alterações de motilidade ou defeitos de mucosa. Pode ser medida por imunoensaio utilizando ELISA e fornece um indicador muito sensível para insuficiência do pâncreas exócrino.
3.4. Carboidratos
Quantidade aumentada de carboidratos nas fezes produz diarreia osmótica pelo açúcar não absorvido na luz intestinal, que desloca fluidos e eletrólitos. Carboidratos podem estar presentes nas fezes como resultado da incapacidade intestinal para reabsorvê-los, como é observado na doença celíaca, ou por falta de enzimas digestivas, como a lactase, o que resulta em intolerância à lactose. Má-absorção ou intolerância a carboidratos é, primariamente analisada por testes no soro e na urina; no entanto, o aumento da concentração de carboidratos pode ser detectado por teste de redução do cobre em amostra fecal. Os testes de carboidrato fecal são mais valiosos para avaliar diarreia infantil e podem ser acompanhados de determinação do pH. Em fezes normais, o pH é entre 7 e 8, entretanto, distúrbios de carboidratos reduzem o pH abaixo de 5,5 e a maior utilização de carboidratos por fermentação bacteriana intestinal aumenta o nível de ácido láctico. O teste de redução do cobre é realizado por um comprimido de Clinitest, em que 0,5 g/dL é indicativo de intolerância a carboidrato. Este é um teste geral para a presença de substância redutoras e um resultado positivo deve ser seguido por testes de tolerância a carboidratos mais específicos O mais comum é o teste D-xilose para má-absorção e o teste de tolerância à lactose para intolerância. A biópsia do intestino delgado para exame histológico e a biópsia para ensaio de atividade enzimática diferenciam a intolerância primária da secundária.
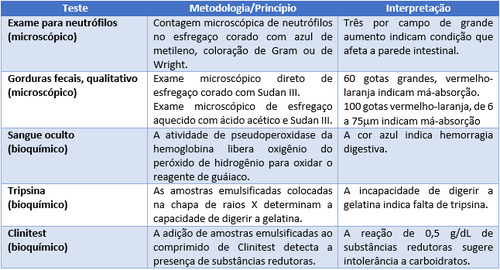
Tabela 1. Resumo dos testes de triagem nas fezes. Modificado de Strasinger, S., K., 2009.
Referência
Strasinger, S., K.; Di Lorenzo, M., S. Urinálise e Fluidos Corporais. Tradução Adagmar Andriolo. 5 ed. São Paulo: Livraria Médica Paulista Editora, 2009. 329 p.
0 notes
Text
INFECÇÕES INTESTINAIS
A doença diarreica é o maior problema da saúde humana e é particularmente devastadora em crianças que sofrem concomitantemente de doenças infecciosas como sarampo, imunodeficiência e subnutrição proteica, frequentes nos países em desenvolvimento. Embora a morbidade e a mortalidade devido à doença diarreica sejam mais importantes em crianças lactentes, esta enfermidade também tem impacto importante em adultos, que sofrem, em média, de um a dois episódios de diarreia anualmente.
As causas das síndromes gastrointestinais acompanhadas de dor, diarreia ou disenteria podem ser: infecciosas, causadas por bactérias, fungos (menos frequentes), vírus, parasitas e protozoários; ou não infecciosas, alérgicas, causadas por erro alimentar, envenenamento, etc. O custo para se fazer um exame de fezes para todos os patógenos em potencial é proibitivo; devem ser desenvolvidas estratégias para assegurar a maior taxa de positividade possível. A identificação dos casos de doenças diarreicas causadas por agentes que necessitam de terapia (que não apenas a hidratação oral) é de particular importância, assim como a identificação do agente etiológico responsável por surtos de toxinfecção alimentar, permitindo a notificação para prevenir transmissões posteriores.
A maioria dos casos de diarreia comunitária em adultos é de causa inflamatória e as fezes podem ser triadas para verificar a presença de leucócitos através da coloração de azul de metileno, entretanto, a sensibilidade é menor que 90%. A ausência de leucócitos não poderá descartar a diarreia inflamatória, mas a presença destes pode indicar os agentes causadores, incluindo microrganismos toxigênicos como Vibrios, E. coli (ETEC), agentes virais e certos agentes parasitários.
Em crianças, o Rotavírus é a causa principal de infecção hospitalar sendo este o único agente para o qual as fezes de crianças com diarreia desenvolvida no hospital devem ser rotineiramente pesquisadas. Em adultos, os estudos têm mostrado que o Clostridium difficile é o único agente bacteriano confiavelmente detectado em fezes de pacientes com diarreia de origem hospitalar. Alguns pacientes, particularmente os imunocomprometidos e os portadores de HIV, podem estar infectados com mais que um agente e o encontro de um agente infeccioso não exclui a possibilidade da presença de outros; assim, o exame deve ser realizado de forma completa.
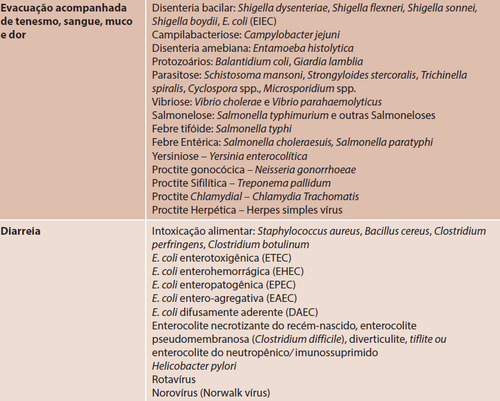
Tabela 1. Principais agentes das diarreias infecciosas. Extraído de ANVISA, 2013.
A detecção do patógenos entéricos bacterianos é complicada pela presença de microflora fecal normal abundante e complexa, a menos que seja induzida uma grande mudança pela terapia antimicrobiana. A flora fecal obtida de adulto normal contém entre 1011 - 1012 microrganismos por grama de fezes, das quais 99% são anaeróbios estritos, predominantemente os pertencentes aos gêneros: Bacteroides, Fusobacterium, Bifidobacterium, Eubacterium e Propionibacterium. Quando comparados com a microflora fecal facultativa, esta é mais modesta em número e variedade, com 108 - 109 organismos por grama de fezes. As infecções intestinais ocorrem em função de fatores ligados ao hospedeiro, como baixa acidez gástrica, que reduz significativamente a dose infectante, microbiota, imunidade, motilidade, etc. e fatores ligados ao agente, destacando-se os fatores de virulência e de inóculo.
Infecções Alimentares de Origem Bacteriana: doença produzida por bactérias capazes de crescer no interior do trato gastrointestinal e de invadir os tecidos ou os fluídos orgânicos do hospedeiro, ou de produzir toxinas (enterotoxinas).
a) Escherichia coli
Bastonetes Gram negativos, pertence à família das enterobactérias, móveis por flagelo ou imóveis, não esporulados e anaeróbios facultativos. Constitui um habitante normal do intestino do homem, mas podem causar infecções em determinadas situações. As cepas mais importantes com potencial de causar diarreia são:
E. coli enteropatogênica (EPEC) ou Clássica: não produtora de enterotoxina e não invasora, mas provoca ações lesivas na mucosa do trato intestinal. Causa frequente de diarreia em crianças em países em desenvolvimento, podendo ocorrer em surtos hospitalares. O quadro clínico característico é a diarreia severa, prolongada, não sanguinolenta, associada à má-absorção e desnutrição.
E. coli enterotoxinogênica (ETEC): produtoras e enterotoxinas, é comum em crianças e uma das causas da diarreia dos viajantes.
E. coli enterohemorrágica (EHEC): produtoras de toxina Shiga. Relacionada à síndrome hemolítica urêmica.
E. coli enteroinvasora (EIEC): invadem as células epitelias do cólon, causando síndrome semelhante à causada pela Shigella com diarreia aquosa, cólica e eventualmente diarreia sanguinolenta.
E. coli é encontrada em praticamente todos os alimentos não processados ou água não clorada, que tenham sido sujeitos a poluição fecal.
b) Salmonella
Bastonetes Gram negativos, pertence à família das enterobactérias, móveis por flagelo, não esporulados e anaeróbios facultativos. Exemplos: S.typhi (febre tifoide), S. typhimurium (enterotoxina), S. enteritidis e S. newport (infecções alimentares).
Contaminação: alimentos de origem animal (leite, queijos, carnes frescas) expostas a fezes humanas e de animais.
Sintomas: vômitos, diarreias, dores abdominais, febre.
c) Shigella
Bastonetes Gram negativos, pertence à família das enterobactérias, imóveis, não esporulados e anaeróbios facultativos, produzem a toxina shiga e causam disenteria bacilar. Exemplos: S. dysenteriae, S. boydii, S. flexneri e S. Sonnei, espécies restritas aos humanos).
Contaminação: poluição fecal.
Sintomas: diarreias, fezes sanguinolentas e com pus, dores abdominais, febre.
d) Yersinia
Bastonetes Gram negativos, pertence à família das enterobactérias, não esporulados e anaeróbios facultativos. Exemplos: Y. enterocolitica (infecções alimentares).
Contaminação: ingestão de alimentos constituídos à base de leite e de carnes brancas (perú).
Sintomas: vômitos, diarreias, dores abdominais, náuseas.
e) Vibrio
Bastonetes Gram negativos, pertence à família das Vibrionaceae, móveis por flagelo, não esporulados e anaeróbios facultativos. Exemplos: V. cholerae (cólera) e V. parahaemoliticus: espécie halofílica, bem adaptada aos ambientes marinhos, associada às infecções alimentares por ingestão de peixe, moluscos e crustáceos contaminados.
Sintomas: desidratação provocada por diarreias excessivas, dores abdominais, vômitos e febre.
f) Brucella
Cocobacilos, Gram negativos, pertence à família das Brucellaceae, imóveis, não esporulados, aeróbios. Exemplos: B. abortus (bovinos), B. melitensis (caprinos) e B. suis (suínos): febre de Malta.
Contaminação: as três espécies são capazes de infectar o homem, sendo a via preferencial por ingestão de produtos lácteos provenientes de animais infectados.
Sintomas: dores musculares generalizadas, cefaleias, calafrios e febre ondulante.
g) Campylobacter
Bastonetes espiralados Gram negativos, pertence à família das Campylobacteraceae, móveis por um único flagelo polar, não esporulados, microaerofílicos. O seu habitat é o trato intestinal e oral de animai como ovinos, aves, cães e gatos. Exemplo: C. jejuni (enterites agudas, comparável às provocadas pelas salmonelas).
Contaminação: ingestão de produtos lácteos
Sintomas: gastrenterites agudas e diarreias.
h) Listeria
Bastonetes Gram positivos, pertence à família das Listeriaceae, móveis, não esporulados, anaeróbios facultativos. Distribuída na natureza, com particular incidência na matéria orgânica em decomposição. Exemplos: Listeria monocytogenes (listerioses em humanos ou em outros animais). Importância em termos de saúde pública.
Contaminação: ingestão de carnes frescas, em particular carne de porco e frango, de leite crú ou deficientemente pasteurizado.
Sintomas: parecida com o quadro patológico da meningite, podendo provocar abortos em grávidas infectadas. O aparecimento dos sintomas após a ingestão do alimento contaminado é muito variável e ocorre com particular incidência nos recém-nascidos e nos idosos.
i) Clostridium
Bastonetes Gram positivos, pertence à família das Clostridiaceae, móveis, esporulados e anaeróbios estritos. Os seus habitats são o solo, os sedimentos de águas marinhas ou doces e o intestino do homem e de outros animais. Exemplos: C. perfringens também conhecida por C. welchii: enterotoxina proteica, sensível ao calor.
Contaminação: ingestão de carne ou frango pré-cozinhados que não sejam adequados e rapidamente refrigerados, permitindo a germinação dos esporos que sobrevivam à pré-cozedur. Uma só célula pode originar uma população superior a 250.000 células em 3 horas!
Sintomas: diarreias, dores abdominais e náuseas. Geralmente, não ocorrem vômitos nem febres.
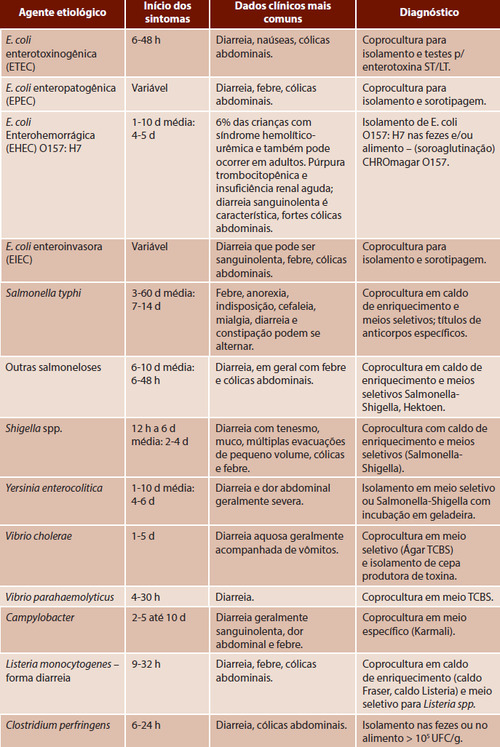
Tabela 2. Bactérias relacionadas a infecções alimentares. Adaptado de ANVISA, 2013.
Intoxicações Alimentares de Origem Bacteriana: por intoxicação alimentar entende-se o estado patológico provocado pela ingestão de alimentos contaminados por toxinas (exotoxinas) pré-formadas, produzidas por microrganismos, como resultado do seu crescimento nos alimentos.
a) Clostridium botulinum
Bastonetes Gram positivos dispostos isoladamente, aos pares ou em cadeia, móveis, esporulados, anaeróbios estritos. Os seus habitats são os mesmos do C. perfringens. O C. botulinum é responsável pela doença conhecida pelo botulismo, intoxicação alimentar grave e, eventualmente, fatal, que afeta o homem causando perturbações neuroparalíticas. Esta espécie produz potentes toxinas termo resistentes, apenas destruídas pelo aquecimento a 80º C - 30min ou a 100º C - 10min. Conhecem-se sete toxinas botulínicas diferentes, classificadas de A a G, de acordo com a sua natureza antigênica.
Contaminação: ingestão de alimentos enlatados, em conserva ou fumados cujos tratamentos térmicos para sua conservação não permitem a destruição dos esporos do C. botulinum.
Sintomas: perda de visão, dificuldades respiratórias e debilidade. Note-se que após o aparecimento dos primeiros sintomas poderá surgir a morte dentro de um dia.
b) Bacillus cereus
Bastonetes Gram positivos, móveis, esporulados, e anaeróbios facultativos. Produz tanto enterotoxina, como exotoxina, dependendo da estirpe. A enterotoxina é de natureza proteica, termolábel, podendo ser destruída a uma temperatura de 60º C - 20min, enquanto a exotoxina é de natureza peptídica, termo resistente, exigindo para ser destruída uma temperatura de 126º C - 90min.
Contaminação: ingestão de águas, alimentos de origem vegetal (cereais) e animal (cárneos e laticínios) contaminados.
Sintomas: vômitos, diarreias e dores abdominais.
c) Staphylococcus aureus
Cocos Gram positivos, formando arranjos irregulares, imóveis, não esporulados, e anaeróbios facultativos. A sua presença nos alimentos pode provir dos próprios manipuladores de alimentos portadores de infecções piogênicas ou de portadores sãos que alojam essas bactérias no nariz, na garganta ou na superfície das mãos. Produz uma exotoxina termo resistente, não afetada pela exposição a uma temperatura de 100º C - 30min.
Contaminação: ingestão de alimentos de origem animal (cárneos e laticínios) deficientemente armazenados e refrigerados.
Sintomas: vômitos, diarreias, dores abdominais e náuseas.

Tabela 3. Bactérias relacionadas a intoxicações alimentares. Adaptado de ANVISA, 2013.
Intoxicações Alimentares de Origem Fúngica: algumas espécies de bolores produzem determinados metabolitos tóxicos, as micotoxinas. As micotoxinas são metabólitos simples, sendo a maioria termo estável, resistindo a determinados tratamentos térmicos ou processos de desidratação, que são suficientes para destruir o micélio vegetativo dos fungos que as produziam. Têm a capacidade de circular na cadeia alimentar sem serem destruídas. Isto significa que alimentos de origem animal (carne e leite) podem estar contaminados se o animal tiver sido alimentado por rações contaminadas.Três gêneros de bolores assumem particular importância na produção de micotoxinas: Aspergillus, Penicillium e Fusarium.
Infecções Alimentares Provocadas Por Outros Agentes:
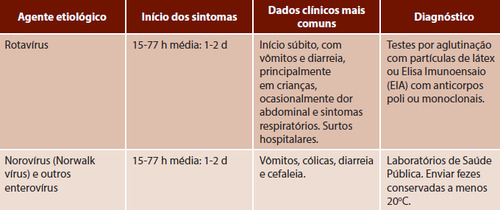
Tabela 4. Vírus relacionadas a infecções alimentares. Extraído de ANVISA, 2013.
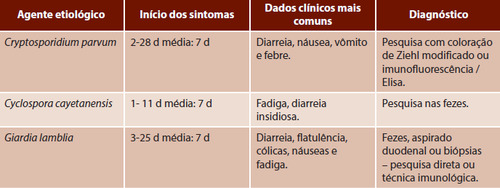
Tabela 5. Protozoários relacionadas a infecções alimentares. Extraído de ANVISA, 2013.
A procura do agente etiológico de diarreia, de disenteria ou de dor abdominal deve contar com a colaboração do médico, dando informações clínicas e, se possível, a suspeita clínica para orientar quais os agentes a serem pesquisados. Constituem informações importantes: idade do paciente; sintomas como diarreia, presença de sangue, pus ou muco, dor abdominal, frequência e volume das evacuações, febre, quadro simultâneo em outras pessoas do convívio; imunossupressão; uso de antibióticos etc.
ASSOCIAÇÕES ENTRE OS ASPECTOS CLÍNCIOS E OS AGENTES ETIOLÓGICOS
Ingestão de frutos do mar: em especial ostras, induz a pesquisa de Vibrio parahaemolyticus, e vírus Norwalk.
Disenteria (muco, sangue e pus, com dor a evacuação): amebíase, Shigella spp, E. coli (EIEC).
Viagem a países tropicais: (a) sem leucócitos nas fezes: E. coli enterotoxinogenica (ETEC), Rotavírus e Norwalk vírus, ou parasitas; (b) com leucócitos nas fezes: E. coli (EIEC), Salmonella spp., Shigella spp., Campylobacter jejuni e Entamoeba histolytica.
Fezes com sangue, sem leucócitos: E. coli (EHEC), pode estar acompanhada de síndrome hemolítico-urêmica, principalmente em crianças. Existe a possibilidade de amebíase.
Diarreia sanguinolenta com leucócitos: E. coli (EIEC), Salmonella spp., Shigella spp., Campylobacter.
Diarreia secretória, cujo quadro importante é a desidratação podendo evoluir para o choque e cujas fezes apresentam aspecto de água de arroz: sugere Vibrio cholerae (cólera).
Diarreia e vômito significativo, em crianças pequenas: sugere Rotavírus.
Diarreia crônica ou subaguda, com ou sem flatulência, pode-se direcionar o exame para o diagnóstico de Giardia. Outras causas de (>10 dias), com perda de peso, lembrar de Cryptosporidium spp. e Cyclospora spp. Ou na suspeita de uma síndrome apendicular pode-se sugerir Yersinia.
Intoxicação com incubação de curta duração, acompanhado de vômito, pode-se sugerir uma intoxicação de origem alimentar causada por toxina de Staphylococcus aureus ou Bacillus cereus.
Dor abdominal sugerindo apendicite, lembrar de Yersinia enterocolítica.
Diarreia acompanhada de artrite: Yersinia enterocolitica.
Em pacientes imunossuprimidos considerar: (a) Vírus: Citomegalovirus, Herpes simplex vírus, vírus Coxsackie, Rotavírus; (b) Bactérias: Salmonella spp., complexo Mycobacterium avium; (c) Parasitas: Cryptosporidium spp., Isospora belli, Strongyloides stercoralis, Entamoeba coli, e Giardia lamblia.
Em surtos de gastroenterocolite, considerar: E. coli (ETEC e EIEC), Salmonella spp., Shigella spp., Vibrio spp., Campylobacter spp., Cryptosporidium spp., C. perfringens, S. aureus, B. cereus e Cyclospora spp.
DIAGNÓSTICO LABORATORIAL
Considerações Gerais
Amostras de fezes recém-emitidas devem ser transportadas para o laboratório preferencialmente, dentro de 30 minutos após a coleta e processadas no prazo de duas horas. Caso contrário deverá ser transferida para um recipiente contendo meio de transporte com Cary-Blair. Cary Blair é indicado para todos os patógenos bacterianos intestinais, exceto Shigella. Salina glicerinada e tamponada é indicada para Salmonella e Shigella. No caso do Clostridium difficile as fezes para teste devem ser enviadas em um recipiente estéril sem o meio de transporte e congeladas a menos 20ºC ou submetidas ao teste rapidamente.
Quando possível, selecionar porções de fezes contendo muco e/ou sangue e/ou pus.
O swab retal pode ser adequado para a detecção de patógenos em infecções agudas, mas NÃO são amostras clínicas ideais para o diagnóstico de rotina.
Fezes e aspirados gastrointestinais podem ser transportados sob refrigeração em frascos estéreis e biópsias podem ser conservadas com um pouco de salina em frasco estéril.
Materiais inadequados para processamento: fezes ou material do trato digestivo transportado a temperatura ambiente sem meio de transporte, amostras contaminadas com urina ou papel higiênico, swab seco ou sem sinais de fezes, biopsias secas, amostras em recipientes com contaminação externa, amostras sem identificação. Em todos esses casos a enfermaria ou o médico deverá ser notificado para solicitação de nova amostra.
Pesquisa de leucócitos e eosinófilos: deve-se enviar fezes frescas para exame (não swab) ou em meio de transporte.
A pesquisa positiva de eosinófilos no muco é sugestiva de diarreia de causa alérgica.
A diarreia de curta duração, com pesquisa negativa para leucócitos e para presença de sangue e de muco pode ser causada por toxina, que tem o diagnóstico difícil pois o agente costuma não estar presente.
Deve-se fazer pedido específico quando suspeitar de agentes como Vibrio cholerae, Campylobacter spp., Cryptosporidium spp. e Isospora belli.
Para pesquisa de Campylobacter há necessidade de meio de cultura específico.
História de uso recente de antibiótico-terapia prolongada deve ser considerada para direcionar a pesquisa de toxina de Clostridium difficile como uma das etiologias. As fezes desses pacientes devem ser testadas somente para a presença de toxina A e B.
Quando não houver informações clínicas ou pedido especifico, a rotina recomendada é a pesquisa dos seguintes agentes:
Salmonella, Shigella, Aeromonas, Plesiomonas, Yersinia: podem ser isolados em Mac Conkey e Salmonella-Shigella. Recomenda-se também a cultura para Campylobacter, que exige meio específico.
No caso de fezes com sangue: pesquisa de EHEC.
Em coprocultura de crianças até 1 ano: pesquisa de EPEC, EHEC, EIEC, Salmonella, Shigella. Deve-se incluir também a pesquisa de Yersinia enterocolítica, Aeromonas e Plesiomonas.
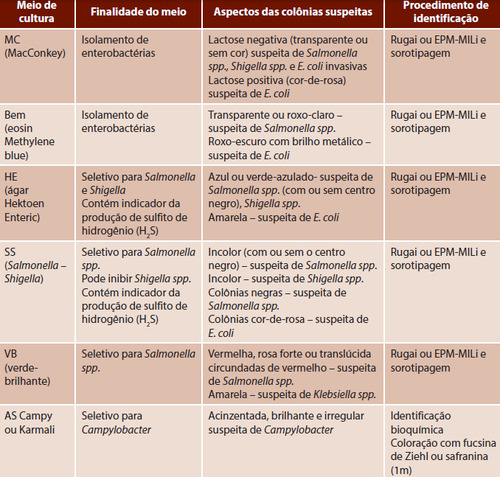
Tabela 6. Características de alguns meios de cultura e sua identificação. Extraído de ANVISA, 2013.
CARACTERÍSTICAS DE ALGUNS MEIOS SÓLIDOS
Ágar Mac Conkey e Ágar Eosin Metilene Blue (EMB) são meios diferenciais, mas não seletivos entre os Gram negativos entéricos.
Ágar Salmonella-Shigella funciona bem para para as Salmonella mas pode inibir Shigella.
Ágar xilose-lisina-desoxicolato (XLD) é recomendado para Salmonella e Shigella, mesmo as mais exigentes.
Ágar Hektoen entérico (HE) é adequado para Salmonella e Shigella.
Ágar verde brilhante (VB) é seletivo para Salmonella sp, mas não é indicado para Salmonella typhi e S. paratyphi.
Ágar sulfito de bismuto (Wilson & Blair) é seletivo para Salmonella.
Caldos de enriquecimento: indicados para detectar baixo número de Salmonella ou Campylobacter em portadores. Muitos laboratórios estão abandonando o uso de caldos de enriquecimento pela baixa recuperação de patógenos.
Caldo GN (Gram Negativo) - enriquecimento de Salmonella e Shigella spp.
Caldo Selenito F - principalmente Salmonella spp.
Caldo Tetrationato - apenas algumas espécies de Salmonella spp e exclui S. typhi.
Campy-tioglicolato - apenas para pesquisa de portadores de C. jejuni.
Salina fosfatada e tamponada pH 7,6 - para semear fezes e conservar em geladeira por três semanas para pesquisa de portadores de Yersinia enterocolitica, mas não indicado para rotina.
RELATÓRIO DE RESULTADOS
Procedimento Geral
Semear uma alçada de fezes em meio seletivo, em meio diferencial, no meio de Skirrow modificado ou Karmali para Campylobacter e 3 a 4 alçadas em caldo de enriquecimento. O meio para isolamento de Campylobacter spp. deve ser incubado em jarra com gerador de microaerofilia, a 42ºC, para haver inibição do crescimento de outras bactérias.
Incubar as placas de MC e SS a 35±1ºC por 18 a 24 horas e o caldo de enriquecimento a 35±1ºC por 12 a 18 horas.
Após 12 a 18 horas de incubação, semear uma amostra da superfície do caldo de enriquecimento em uma placa de meio seletivo.
As colônias suspeitas do primeiro plaqueamento são repicadas no meio de Rugai ou EPM-MILi. Colônias suspeitas no MC e SS que devem ser identificadas:
MC – Colônias lactose positiva e lactose negativa.
SS – Colônias incolores pequenas produtoras ou não de H2S.
Recomenda-se repicar ao menos 3 a 5 colônias com morfologia diferente, de cada placa, para o meio de identificação.
Incubar a placa semeada do caldo de enriquecimento e o meio de identificação a 35±1ºC por 18 a 24 horas.
Após 48 horas abrir a jarra de microaerofilia e verificar se há crescimento de colônias suspeitas de Campylobacter spp. Fazer um esfregaço em uma lâmina da colônia suspeita e corar com fucsina de Ziehl (0,1%) ou safranina por 1 minuto. Morfologia sugestiva – bacilos corados em rosa, delicados, em forma de vírgula ou “asa de gaivota”.
Quando na leitura do meio de identificação houver suspeita de algum patógeno significativo, realizar provas bioquímicas complementares (se necessário) e soroaglutinação.
E. coli – identificar o sorogrupo a que pertence.
Salmonella spp. – deve ser feita soroaglutinação.
Shigella spp. – deve ser feita soroaglutinação para identificar as diferentes espécies, S. dysenteriae, S. boydii, S. sonnei e S. flexneri.
–– Todas as aglutinações podem ser realizadas adicionando 0,5 mL de solução fisiológica diretamente do meio de identificação e seguir a recomendação do fabricante dos anti-soros. Homogeneizar bem para fazer uma suspensão bacteriana densa com aspecto leitoso. Qualquer que seja o antígeno, este e o soro devem ser bem misturados para formar uma suspensão homogênea. Reações de aglutinação positivas ocorrem dentro de 2 minutos; reações mais demoradas devem ser consideradas negativas.
8. Da placa semeada a partir do caldo de enriquecimento, repicar no meio de identificação as colônias suspeitas e incubar a 35±1ºC por mais 18 a 24 horas.
9. Liberar o resultado das bactérias confirmadas por meio de soroaglutinação.
10. Ler os meios de identificação repicados da placa proveniente da semeadura do caldo de enriquecimento e proceder a soroaglutinação quando necessária para confirmar a identificação.
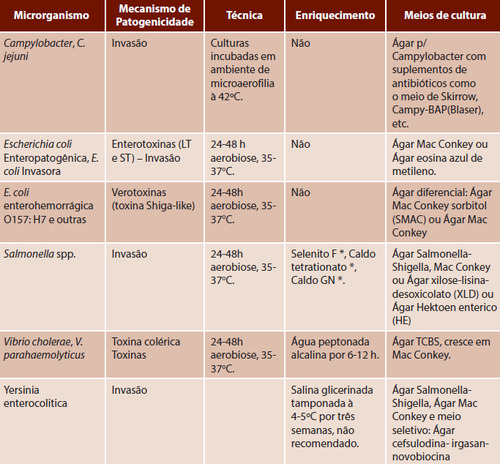
Tabela 7. Procedimentos gerais para o isolamento dos principais agentes microbianos das infecções intestinais. Extraído de ANVISA, 2013.
* Atualmente questiona-se a necessidade do uso de caldos de enriquecimento, ficando a critério de cada usuário.
Relatório de resultados
É incorreto emitir o resultado como “não foram isolados patógenos”, se as fezes foram cultivadas somente para recuperar alguns patógenos. Ao invés disso o relatório deve afirmar “não foram isoladas Salmonella, Shigella e Campylobacter” ou para algum outro patógeno efetivamente pesquisado.
O protocolo deverá prever laudos relatando a ausência da flora fecal Gram negativa e a presença de quantidade significativa de microrganismos como S. aureus, leveduras e Pseudomonas aeruginosa.
Se as amostras fecais ou as cepas isoladas forem enviadas ao Laboratório de Referência para trabalho posterior, tais como pesquisa da presença de toxina de C. difficile ou sorotipagem de cepas de Salmonella, o relatório para os referidos exames deve incluir o nome do laboratório de referência e as provas realizadas (sorotipagem e determinação das toxinas, etc.).
Referência:
Agência Nacional de Vigilância Sanitária. Manual de Microbiologia Clínica para o Controle de Infecção Relacionada à Assistência à Saúde. Módulo 3: Principais Síndromes Infecciosas. Brasília: Anvisa, 2013. 156: il.9 volumes. Disponível em: http://portal.anvisa.gov.br, acesso em 26/01/2015.
1 note
·
View note
Text
Meios de Cultura Empregados nos Exames Microbiológicos
Procedimentos gerais para preparação e distribuição de meios de cultura
Usar EPIs para o preparo de meios de cultura (máscaras, jaleco de manga longa e touca). Observar os riscos indicados nos rótulos dos frascos de meios de culturas e de reagentes químicos e fazer uso de EPIs específicos.
Usar vidrarias limpas, secas e sem trincos ou defeitos, feitas em vidro neutro temperado, termo resistente com parede uniforme e reforçado.
Esterilizar a vidraria pelo processo de calor seco (forno Pasteur) 170°C por 120 minutos ou 180°C por 60 minutos.
Usar água destilada, deionizada, ou produzida por osmose reversa na preparação de meios de cultura e soluções.
Os meios comerciais devem ser hidratados em pequena quantidade de água até que todo o meio fique úmido e só depois deve-se acrescentar o restante da água.
Os preparados não comerciais devem ser pesados separadamente em papel manteiga e adicionados em uma única vidraria adequada (normalmente em Béquer), hidratar em pequena quantidade de água até que todo o meio fique úmido. Agitar firmemente por alguns segundos até obter uma suspensão homogênea. Escorrer o restante da água pela parede para retirar qualquer material aderente.
Ajustar o pH dos meios preparados não comerciais com solução de HCl e NaOH 0,1N ou 1N. Nos meios contendo Ágar, pesar o Ágar separadamente e acrescentar após o ajuste do pH para não obstruir o eletrodo. O pH dos meios comerciais, normalmente, não precisa ser reajustado mas deve ser verificado a cada lote.
Dissolver os meios líquidos e soluções com agitação e leve aquecimento (não abrir fervura).
Aquecer os meios contendo Ágar até ferver com constante agitação. A parede da vidraria deve estar lisa sem pontos de Ágar. Caso observe pontos, a fervura não foi suficiente para a total dissolução. Retornar ao fogo para finalizar o procedimento.
Sempre que for necessário o aquecimento dos meios, usar vidro termo resistente tipo Pyrex e aquecer sobre a tela de amianto ou similar e tripé, no bico de Bunsen ou em placa aquecedora.
Usar sempre luvas térmicas apropriadas para laboratório para manipular vidrarias quentes.
Quando for usado o termo “esterilizar em autoclave”, o tempo de esterilização é de 15 minutos e a temperatura de 121°C. Observar as recomendações contidas no rótulo ou no manual do fabricante.
Sempre que for usado o termo “esterilizar por filtração”, usar membrana composta por ésteres de celulose ou polímeros plásticos e com porosidade de 0,22μm de diâmetro, recomendado para reter partículas bacterianas. A esterilização por filtração é utilizada quando o material e sensível ao calor.
Quando distribuir o meio antes de autoclavar, os tubos não precisam estar esterilizados.
Quando distribuir o meio após a autoclavação, os tubos, frascos, placas, pipetas e vidrarias ou materiais auxiliares obrigatoriamente devem ser estéreis.
Os meios devem ser autoclavados com as tampas semiabertas, para que a esterilização seja por igual em todo o conteúdo dos tubos. Tampas fechadas não permitem a entrada do vapor.
Controle de qualidade de esterilidade e crescimento
Avaliar sistematicamente os meios de culturas e soluções quanto a qualidade de crescimento, a seletividade, as características bioquímicas diferenciais e as características físicas.
Para o controle de esterilidade, todos os meios confeccionados devem ter no mínimo 10% do lote preparado colocado na estufa 35 ±1°C por 24 horas. Não deve haver mudança de cor nem crescimento de qualquer colônia.
Para o controle de crescimento, sempre que possível usar cepas ATCC, que são cepas de referências de origem e padrão definido de provas para a sua caracterização.
Se não for possível o uso de cepas ATCC, usar cepas 100% positivas para os controles de qualidade de crescimento realizadas.
Usar cepas de micro-organismos de referência obtidas diretamente de uma coleção nacional ou internacional reconhecida ou culturas comerciais com propriedades equivalentes comprovadas para avaliação de desempenho dos meios de cultura e de outras soluções preparadas no laboratório.
Manter instrução de manutenção e preparo de cultura de trabalho no laboratório. (consultar ISO 11133-1).
Controlar a eficácia da autoclave ou estufa, realizando semanalmente teste biológicos para essa finalidade. Os testes para autoclaves a vapor são os que contêm 106 Geobacillus stearothermophilus e os para estufa de calor seco contêm 106 Bacillus subtilis.
Recomendações gerais
Não usar meios prontos para uso em tubos ou placas que estejam ressecados ou vencidos.
Evitar usar meios liofilizados e prontos para uso vencidos; se usar, certifique-se com o controle de crescimento de que realmente está funcionando.
A validade dos meios preparados, mantidos nas condições definidas de armazenamento, deve ser determinada e controlada.
Observar com atenção para as instruções dos rótulos pois, dependendo do fabricante, podem ter o mesmo nome, mas composição diferente e portanto ser diferente a quantidade de meio a ser usada.
Recomenda-se o uso de tubos com tampa de rosca, pois evitam o ressecamento rápido do meio.
As placas de Petri são de 50, 90 ou 150 mm de diâmetro.
Todos os meios confeccionados devem ser devidamente identificados com o nome, data de fabricação, número de lote interno do laboratório, data de validade e tipo de armazenamento.
Todos os meios em placa devem ser embalados na posição invertida e em filme plástico PVC transparente e de papel grau cirúrgico para evitar o ressecamento.
Evitar o uso de sacos plásticos para embalar as placas, pois a água de condensação formada facilita a proliferação de fungos; para meios de cultura em tubos, colocar em sacos plásticos, procurando tirar o excesso de ar.
A estocagem dos meios deve ser entre 2 e 8°C e, preferencialmente, devem ser hermeticamente fechados para se evitar contaminação e ressecamento deles.
Tipos de Meio de Cultura
Meio Simples: possui os nutrientes essenciais para o crescimento dos micro-organismos pouco exigentes. Ex. Caldo Simples.
Meio Complexo ou Quimicamente não definido: contém ingredientes razoavelmente conhecidos (peptonas, extratos de carne e de levedura, etc.) porém a composição química pode variar.
Meio Enriquecido: além das fontes nutricionais usuais, são adicionados sangue, soro, ovo, extrato tecidual, etc., permitindo o crescimento de micro-organismos exigentes que necessitem de fatores de crescimento, mas não inibem o crescimento de outros. Ex. Ágar Sangue, Ágar Chocolate.
Meio Seletivo: a adição de certas substâncias químicas, como corantes, antibióticos e etc., favorece o crescimento de determinados micro-organismos em detrimento de outros. Ex. Ágar Mac Conkey, Ágar Salmonella-Shigella, Ágar Sabouraud.
Meio Diferencial: a incorporação de certos reagentes ou substâncias químicas ao meio evidenciam uma característica que permite diferenciar um grupo ou uma espécie de micro-organismos. Ex. Ágar Sangue, Ágar Mac Conkey.
1. Meios de Cultura para Transporte e Conservação
1.1 Salina Tamponada
Princípio: meio líquido tamponado que mantém a bactéria viável.
Utilidade: meio de transporte de fezes.
Interpretação: crescimento é indicado pela turbidez do meio. Após a incubação, semear 3 a 4 alçadas da amostra em uma placa de SS e/ou MacConkey.
1.2 Cary Blair
Princípio: foi formulado a partir do meio de Stuart, uma vez que micro-organismos patogênicos e outros coliformes fecais sobrevivem bem nesse meio. É carente em fonte de nitrogênio, o que impede consideravelmente a multiplicação de micro-organismos, enquanto a composição nutritiva garante a sobrevivência deles. O que difere os meios Cary Blair e Stuart é a adição de uma solução salina balanceada de tampão fosfato inorgânico e a retirada da fórmula o azul de metileno no Cary Blair.
Utilidade: transporte de material fecal e conservação dos micro-organismos.
Interpretação: a cor original do meio é branca opalescente. Como esse é um meio de transporte, não há evidência de crescimento bacteriano.
Recomendações: não deixar o meio com a tampa aberta ou semiaberta após a semeadura e não semear fezes coletadas com mais de 6 horas.
1.3 Meio Stuart
Princípio: assim como o meio Cary Blair, a carência de uma fonte de nitrogênio impede consideravelmente a multiplicação de micro-organismos, enquanto a composição nutritiva garante a sobrevivência deles.
Utilidade: transporte de diversos materiais e conservação dos micro-organismos. Conservação de micro-organismos patogênicos como: Salmonella spp., Shigella spp., Haemophilus spp., Streptococcus pneumoniae, entre outros.
Interpretação: a cor original do meio é branca opalescente. Como esse é um meio de transporte, não há evidência de crescimento bacteriano.
Recomendações: não deixar o meio com a tampa aberta ou semiaberta após a semeadura e não semear fezes coletadas com mais de 6 horas.
1.4 Ágar Nutriente
Princípio: é um meio simples, de fácil preparação e barato, muito usado nos procedimentos do laboratório de Microbiologia.
Utilidade: análise de água e de alimentos como meio para cultivo preliminar das amostras submetidas a exames bacteriológicos e isolamento de organismos para culturas puras. O uso mais frequente é para a conservação e manutenção de culturas em temperatura ambiente, como método opcional para os laboratórios que não dispõem do método da crio conservação (congelamento das cepas em freezer a – 70ºC). Também é usado para observar esporulação de espécies de bacilos Gram-positivos.
Interpretação: a cor original do meio é branca opalescente.
Positivo: crescimento na superfície do Agar.
Negativo: por ser um meio geral, não cabe fazer controle negativo.
Recomendações: por ser um meio nutritivo, a ausência de crescimento não deverá ocorrer.
2. Meios de Cultura para Crescimento e Isolamento
2.1 Caldo Selenito com Novobiocina
Princípio: Meio Enriquecido e Seletivo. Possui propriedades que inibem coliformes e outras espécies da flora intestinal como estreptococos.
Utilidade: enriquecimento e isolamento de Salmonella spp. e Shigella spp. em amostras de fezes, urina e alimentos.
Interpretação: a cor original do meio é vermelho tijolo.
Recomendações: não autoclavar, pois contém antibiótico.
2.2 Caldo Tetrationato
Princípio: Meio Enriquecido e Seletivo. Os sais de bile inibem micro-organismos Gram-positivos. A adição da solução de iodo e de verde brilhante 0,1% inibe a flora intestinal normal de espécies fecais.
Utilidade: enriquecimento para Salmonella spp.
Interpretação: a cor original do meio é límpida com precipitado branco. O crescimento é indicado pela turbidez do meio. Após a incubação, semear 3 a 4 alçadas da amostra em uma placa de SS e/ou Mac Conkey.
2.3 Ágar Mac Conkey
Princípio: Meio Seletivo e Diferencial. O cristal violeta e os sais de bile inibem micro-organismos Gram-positivos, especialmente enterococos e estafilococos. Como a concentração de sais de bile é relativamente baixa em comparação com outros meios, não é tão seletivo para Gram-negativos como, por exemplo, o Ágar SS, a seguir. A incorporação de lactose ao meio e a presença do indicador de pH vermelho neutro permitem diferenciar os micro-organismo em lactose positiva (bactérias que fermentam a lactose produzem ácido resultando em colônias de cor rosa), ou lactose negativa (bactérias que não fermentam a lactose formam colônias transparentes).
Utilidade: isolar bacilos Gram-negativos (enterobactérias e não fermentadores) e verificar a fermentação ou não da lactose.
Interpretação: a cor original do meio é rosa avermelhado.
Há crescimento de bacilos Gram-negativos e não há crescimento de cocos Gram-positivos.
Colônias cor de rosa: fermentadoras de lactose; suspeita de E. coli, Proteus.
Colônias incolores: não fermentadoras de lactose; suspeita de Salmonella e Shigella.
2.4 Ágar Salmonella-Shigella (SS)
Princípio: Meio Seletivo e Diferencial. Os sais de bile, o verde brilhante e o citrato de sódio inibem os micro-organismos Gram-positivos. Assim como no Ágar Mac Conkey, a incorporação de lactose ao meio e a presença do indicador de pH vermelho neutro permitem diferenciar os micro-organismo em lactose positiva ou lactose negativa. O tiossulfato de sódio e o citrato férrico permitem a detecção de H2S evidenciado por formação de colônias de cor negra no centro.
Utilidade: selecionar e isolar espécies de Salmonella e Shigella, em amostras de fezes, alimentos e água.
Interpretação: a cor original do meio é vermelha alaranjada.
Colônias com centro negro (H2S) ou colônias incolores: suspeita de Salmonella.
Colônias incolores: suspeita de Shigella spp.
Colônias cor de rosa ou vermelho: suspeita de Escherichia coli ou Klebsiella spp.
Recomendações: quando na ausência de crescimento ou crescimento escasso, reincubar a placa mais 24 horas. Não autoclavar, pois a alta temperatura degrada o açúcar contido no meio.
2.5 Ágar Chocolate
Princípio: Meio Enriquecido, amplamente utilizado para o cultivo de micro-organismos exigentes, embora cresçam quase todos os tipos de micro-organismos. À base do meio é adicionado sangue de cavalo, carneiro ou coelho e levado para banho-maria a 80-85°C por 15 minutos, fazendo com que as hemácias lisem e liberem hemina e hematina, fundamentais para o crescimento dos micro-organismos exigentes.
Utilidade: crescimento de micro-organismos exigentes Haemophilus spp., Neisseria spp., Branhamella catarrhalis e Moraxella spp.
Interpretação: a cor original do meio é castanho escuro (chocolate).
Colônias de tamanho pequeno a médio, com pigmento amarelo: sugestivo de Neisseria spp., Branhamella catarrhalis ou Moraxella spp.
Colônias pequenas e delicadas, com pigmento creme claro: sugestivo de Haemophilus spp.
Recomendações: como o meio é rico, crescem vários tipos de micro-organismos. Deve-se isolar a colônia em estudo, garantindo não estar trabalhando com cepas misturadas, e fazer esfregaço de todas as colônias suspeitas, corando-as pela técnica de Gram, para confirmar se trata ou não de Neisseria spp., Branhamella catarrhalis ou Moraxella spp. (cocos Gram-negativos reniformes) ou Haemophilus spp. (bacilos Gram-negativos delicados e pleomórficos).
2.6 Ágar Thayer-Martin Chocolate
Princípio: Meio Seletivo, rico e superior a outros meios de cultivo destinados para o isolamento de Neisseria gonorrhoeae e Neisseria meningitidis, pois contém antibióticos que inibem o crescimento de bactérias do gênero Neisseria saprófitas e outras bactérias.
Utilidade: isolamento seletivo de Neisseria gonorrhoeae e Neisseria meningitidis.
Interpretação: a cor original do meio é castanho escuro (chocolate).
Colônias pequenas com pigmento creme: sugestivo de Neisseria gonorrhoeae e Neisseria meningitidis.
Recomendações: fazer esfregaço de todas as colônias suspeitas, corando-as pela técnica de Gram, para confirmar se trata ou não de Neisseria (diplococos Gram-negativos reniformes). Confirmando a morfologia pelo Gram, seguir identificação com testes de oxidase e provas de fermentação. Antes de semear o material biológico aquecer o meio de cultura em estufa a 35ºC, pois temperaturas baixas podem inibir o crescimento de Neisseria. Se não for incubado em CO2 e não houver crescimento, pode ser um resultado falso-negativo, pois bactérias do gênero Neisseria necessitam de atmosfera com o CO2 para o crescimento. Se não houver crescimento, incubar até 5 dias.
2.7 Ágar Sangue
Princípio: Meio Enriquecido e Diferencial. Usa uma base rica, que oferece ótimas condições de crescimento à maioria dos micro-organismos. A conservação dos eritrócitos íntegros favorece a formação de halos de hemólise nítidos, úteis para a diferenciação de Streptococcus spp. e Staphylococcus spp.
Utilidade: isolamento de micro-organismos não fastidiosos. Verificação de hemólise dos Streptococcus spp. e Staphylococcus spp. Usado também na prova de satelitismo (para identificação presuntiva de Haemophilus spp.).
Interpretação: a cor original do meio é vermelha.
Beta hemólise (lise total dos eritrócitos): presença de halo transparente ao redor das colônias. Ex. Streptococcus pyogenes, Staphylococcus aureus.
Alfa hemólise (lise parcial dos eritrócitos): presença de halo esverdeado ao redor das colônias. Ex. Streptococcus pneumoniae.
Gama hemólise (sem hemólise): ausência de halo ao redor das colônias, eritrócitos permanecem íntegros.
Recomendações: não usar sangue de carneiro vencido, pois o meio fica hemolisado ou com cor muito escura, dificultando o estudo de hemólise. Não usar sangue humano, pois alguns micro-organismos não apresentam hemólise, gerando resultados falso-negativos. Não adicionar o sangue na base do meio quente, pois as hemácias rompem-se. Por ser um meio rico, o crescimento costuma ser abundante. Sempre que necessário, isolar a colônia em estudo para os procedimentos de identificação, garantindo não estar trabalhando com cepas misturadas.
2.8 Meio de Tioglicolato sem indicador
Princípio: Meio Enriquecido. As substâncias redutoras tioglicolato, cisteína e sulfito de sódio produzem uma anaerobiose suficiente para micro-organismos anaeróbios exigentes.
Utilidade: cultivo de micro-organismos anaeróbios, como Clostridium tetani, C. perfringens, C. butulinium.
Interpretação: a cor original do meio é amarelo-claro. O crescimento é indicado pela turbidez do meio.
Recomendações: não usar meios que estejam turvos. Se necessário, incubar por um período superior a 48 horas.
2.9 Caldo BHI – Brain Heart Infusion
Princípio: Meio Diferencial, derivado de nutrientes de cérebro e de coração, peptona e dextrose. A peptona e a infusão são fontes de nitrogênio, carbono, enxofre e vitaminas. A dextrose é um carboidrato que os micro-organismos utilizam para fermentação.
Utilidade: cultivo de estreptococos, pneumococos, meningococos, enterobactérias, não fermentadores, leveduras e fungos. Pode ser utilizado na preparação do inoculo para teste de susceptibilidade aos antimicrobianos, para realização de teste de coagulase em tubo, para teste de crescimento bacteriano a 42 e 44°C e para teste de motilidade em lâmina.
Interpretação: a cor original do meio é amarelo-claro, límpido. O crescimento é indicado pela turbidez do meio.
Recomendações: para cultivo de anaeróbios, acrescentar 0,1% de Ágar. Para crescimento de Haemophilus e outros fastidiosos é necessária adição de suplementos a base de L-cisteina, NAD (fator V) e hemina (fator X).
2.10 Ágar Cled – Cystine Lactose Electrolyte Deficient
Princípio: Meio Seletivo e Diferencial. Isolamento e quantificação de micro-organismos presentes em amostras de urina. A deficiência de eletrólitos inibe o véu de cepas de Proteus. Organismos que fermentam lactose baixam o pH e mudam a cor do meio de verde para amarelo, podendo assim verificar se o micro-organismo é lactose negativa ou positiva.
Utilidade: isolar e quantificar micro-organismos Gram-positivos, Gram-negativos e leveduras.
Interpretação: a cor original do meio é azul claro.
Colônias lactose positiva: cor amarela.
Colônias lactose negativa: cor azul.
A) Características de crescimento:
Escherichia coli: colônias opacas, amarelas com ligeira cor amarelo escuro no centro, com cerca de 1,25 mm de diâmetro; as não fermentadoras de lactose formam colônias azuis.
Espécies de Klebsiella: colônias muito mucosas, cor variável de amarelo a branco azulado.
Espécies de Proteus: colônias azuis translúcidas, geralmente menor que E.coli.
Espécies de Salmonella: colônias planas, cor azul.
Enterococcus faecalis: colônias amarelas, com cerca de 0,5 mm de diâmetro.
Staphylococcus aureus: colônias amarelas, com cerca de 0,75 mm de diâmetro.
Staphylococcus coagulase negativa: colônias amarelas palha e brancas.
Corynebacterium: colônias pequenas e cinza.
Lactobacilos: colônias pequenas e com superfície rugosa.
Pseudomonas aeruginosa: colônias verdes, com superfície prateada e periferia rugosa.
Observação: espécies de Shigella não crescem em meios deficientes em eletrólitos.
2.11 Meio Löwenstein Jensen
Princípio: Meio Enriquecido por ovos integrais, o que permite amplo crescimento das micobactérias e o crescimento e satisfatório para o teste de niacina (que e positivo para Mycobacterium tuberculosis).
Utilidade: isolamento primário das micobactérias.
Interpretação: a cor original do meio é verde-claro.
Positivo: crescimento de colônias amarelas.
Negativo: ausência de crescimento.
Recomendações: como é um meio rico em proteínas, bactérias proteolíticas contaminam o meio, liquefazendo-o, para isto, deve-se fazer uma leitura com 24 horas de incubação para tirar as culturas que possam ter contaminado. Não liberar culturas negativas com tempo inferior a 60 dias de incubação, pois as micobactérias desenvolvem-se lentamente. Fazer um esfregaço do crescimento e corar pela técnica de Ziehl para confirmar ser um Bacilo Álcool Acido Resistente (BAAR), pois alguns contaminantes podem crescer com pigmento amarelo.
2.12 Ágar Mycosel
Princípio: Meio Seletivo. A Cicloheximida serve para selecionar fungos dermatófitos e o cloranfenicol para inibir o crescimento de bactérias e alguns fungos filamentosos.
Utilidade: isolamento de fungos patogênicos, principalmente dermatófitos.
Interpretação: a cor original do meio é amarelo claro opalescente. Após o crescimento, deve-se seguir a identificação do micro-organismo que cresceu.
Recomendações: a ausência de crescimento não indica uma cultura negativa para fungos, pois alguns deles podem ter o crescimento inibido nesse meio. Recomenda-se o uso de meios em tubos, pois a incubação demorada resseca com facilidade o meio contido em placas.
2.13 Ágar Sabouraud Dextrose
Princípio: Meio Enriquecido. Contém nutrientes que favorecem o crescimento de diversos fungos leveduriformes e filamentosos.
Utilidade: cultivo e crescimento de espécies de Candidas e fungos filamentosos, particularmente associados a infecções superficiais. Caracterização macroscópica do fungo filamentoso (colônia gigante).
Interpretação: a cor original do meio é amarelo claro opalescente. Após o crescimento, deve-se seguir a identificação do micro-organismo que cresceu.
Recomendações: recomenda-se o uso de meios em tubos, pois a incubação demorada resseca com facilidade o meio contido em placas. Não usar meios vencidos e/ou ressecados. Para suspeitas de Histoplamasma capsulatum e Paracoccidioides brasiliensis, semear em BHI Ágar.
3. Meios Comerciais para Provas de Identificação
3.1 Ágar Citrato Simmons
Princípio: capacidade de algumas bactérias de utilizar o citrato de sódio como única fonte de carbono (meio não tem peptona), alcalinizando o meio.
Utilidade: diferenciar gêneros e espécies de enterobactérias e não fermentadores.
Interpretação: a cor original do meio é verde.
Positivo: cor azul (alcalino) ou crescimento no local do inoculo.
Negativo: não há crescimento e a cor permanece inalterada.
Se houver crescimento na área do inoculo sem mudança de cor, o teste pode ser considerado positivo; reincubar por 24 a 72 horas, podendo haver mudança de cor do meio para azul.
Recomendações: manter a tampa do tubo frouxa, o meio necessita de oxigênio. Não transportar colônias de meios que contenham glicose ou outros nutrientes/substratos, pois podem entrar em contato com o meio de citrato, podendo dar um resultado falso positivo. Se algum resultado estiver duvidoso, inocular um novo tubo e incubar em temperatura ambiente (22 a 25°C) por até 7 dias. Deixar o tubo em temperatura ambiente antes de inocular a bactéria. Não fazer inoculo muito denso (pode acidificar o meio deixando-o amarelo).
3.2 Ágar Bile-Esculina
Princípio: capacidade de algumas bactérias hidrolisarem esculina em presença de bilis. As bactérias Bile-Esculina POSITIVAS, são capazes de crescer em presença de sais biliares. A hidrólise da esculina no meio resulta na formação de glicose e esculetina; esta reage com íons férricos (citrato férrico), formando um complexo negro.
Utilidade: separação dos Streptococcus Bile-Esculina positiva dos Bile-Esculina negativa. Identificação dos Enterococcus spp., que são Bile-Esculina positiva.
Para identificação de bacilos Gram-negativos não fermentadores e enterobactérias, usar o meio sem bilis (prova de esculina).
Interpretação: a cor original do meio é acinzentada.
Positivo: enegrecimento em pelo menos metade ou mais do meio.
Negativo: ausência de enegrecimento ou crescimento de menos da metade do meio após 72 horas de incubação.
Recomendações: para provas negativas com 24 horas de incubação, recomenda-se período de incubação maior (48 horas). Alguns Streptococcus do grupo viridans podem hidrolisar a esculina em presença de bilis se incubados em atmosfera de CO2.
3.3 Ágar Sangue – CAMP
Princípio: interação da beta hemólise secretada pelo Staphylococcus aureus com o micro-organismo em estudo, que secreta uma proteína, “fator CAMP”, produzindo aumento de hemólise no local da inoculação.
Utilidade: separação do Streptococcus beta hemolítico presumível do grupo B de Lancefield (S. agalactiae) e da Listeria monocytogenes (CAMP positivos) dos demais Streptococcus beta hemolíticos e espécies de Listeria.
Interpretação:
Positivo: aumento da área de hemólise em forma de flecha no local onde estão mais próximas as duas estrias de crescimento.
Negativo: ausência desse aumento. Observa-se a hemólise do S. aureus e da cepa em estudo, inalteradas.
Recomendação: não utilizar cepas velhas de S. aureus, pois podem não produzir beta hemolisina. Não tocar as estrias da semeadura das cepas, para não dar resultado falso -negativo. Não utilizar placas de Ágar Sangue velhas que dificultem a leitura da prova.
3.4 Ágar Dnase
Princípio: cepas de alguns micro-organismos produzem DNase e endonuclease termoestável, que hidrolisam o DNA do meio de cultura. Posteriormente esse meio é acidificado com HCl 1Npara a revelação da prova.
Utilidade: separa os principais micro-organismos de importância clínica:
DNase positivos: Staphylococcus aureus, Serratia spp. e Proteus spp., Stenotrophomonas maltophilia, Cryseobacterium meningosepticum, Moraxella catarrhalis.
DNase negativos: Staphylococcus coagulase negativa, demais enterobactérias, demais bacilos Gram-negativos não fermentadores.
Interpretação:
A) Revelação com HCl 1 N: cor original do meio é amarelo-claro.
Positivo: presença de halo claro na parte inferior e em volta da colônia.
Negativo: ausência de halo claro em volta da colônia.
B) Revelação com azul de toluidina O: cor original do meio é azul claro
Positivo: presença de coloração rosa na parte inferior e em volta da colônia.
Negativo: ausência de cor rosa. O meio permanece com a cor original, azul.
Recomendações: usar sempre uma cepa controle positivo para facilitar a leitura da prova. Para a detecção da atividade de DNase não e necessário que haja crescimento, por isso e que semeadura deve ser de forma circular densa e não de estria.
3.5 Ágar TSI – Triplo Açúcar Ferro
Princípio: contém três açúcares: glicose, lactose e sacarose. Utiliza o indicador de pH vermelho de fenol para detecção da fermentação de carboidratos, que gera mudança da cor de vermelho ou púrpura (alcalino) para amarelo (ácido) e sulfato de ferro para detecção da produção de sulfato de hidrogênio (cor preta na base do tubo). Há duas câmaras de reação dentro do mesmo tubo. A porção inclinada ou bico, exposta ao oxigênio é aeróbia, enquanto a porção inferior, coluna ou fundo, está protegida do ar e é relativamente anaeróbia. Na coluna, há baixa concentração de O2 e, por isso, a utilização de glicose é preferencial.
Utilidade: diferenciar bacilos Gram-negativos com base na fermentação de carboidratos, na produção de sulfato de hidrogênio e de gás.
Interpretação: a cor original do meio é vermelha ou púrpura, levemente opalescente. Reações ápice/base:
Púrpura/amarelo: fermentação apenas da glicose.
Amarelo/amarelo: fermentação da glicose + lactose e/ou sacarose (2 ou 3 açúcares).
Presença de gás (CO2): bolhas ou meio fragmentado
H2S positivo: precipitado negro. Quando há H2S significa que a bactéria usou toda a glicose e acidificou o meio.
Recomendações: não realizar leitura com menos de 18 ou mais de 24 horas.
3.6 Caldo Triptona e SIM
Princípio: habilidade de alguns micro-organismos metabolizarem o triptofano em indol, após a adição de reagentes de Erlich ou de Kovacs.
Utilidade: diferenciar gêneros e espécies de enterobactérias, não fermentadores, Haemophilus e anaeróbios.
Interpretação: após incubação, revelar com reagente de Ehrlich ou Kovacs, dependendo reagentes da preferência dos Gram-negativos não fermentadores ou anaeróbios, que podem produzir mínima quantidade de indol.
H2S positivo: cor negra ao longo da linha de inoculação.
H2S negativo: linha ao longo da inoculação inalterada.
Indol positivo: anel vermelho logo abaixo da camada de xilol.
Indol negativo: permanecerá anel amarelo logo abaixo da camada de xilol.
Motilidade positiva: micro-organismos difundem-se no meio causando turbidez.
Motilidade negativa: bactéria tem um crescimento acentuado apenas ao longo da linha do inoculo.
3.7 Ágar Fenilalanina
Princípio: capacidade de algumas bactérias de produzirem fenilalaninadesaminase, que age sobre a fenilalanina formando ácido fenilpirúvico. Esta, na presença de cloreto férrico, desenvolve uma coloração verde (garrafa) intenso.
Utilidade: diferenciar gêneros e espécies de enterobactérias.
Interpretação: adicionar diretamente o cloreto férrico no tubo inoculado, antes da interpretação do resultado e distribuir o reagente sobre a superfície do meio. A cor original do meio é amarelo-palha.
Positivo: coloração esverdeada na superfície do meio após a adição do cloreto férrico.
Negativo: o meio permanece amarelo, inalterado.
Recomendações: resultado positivo deve ser interpretado imediatamente após a adição do reagente (em até 5 minutos), pois a cor verde desbota rapidamente.
3.8 Ágar Base Ureia (Christensen)
Princípio: capacidade de alguns micro-organismos de utilizarem a uréase para degradar a ureia em duas moléculas de amônia, resultando na alcalinização do meio. A utilização do indicador de pH vermelho de fenol permite detectar a mudança de cor de amarelo para rosa (alcalino).
Utilidade: identificar bacilos Gram-negativos fermentadores e não fermentadores, Staphylococcus e Haemophilus.
Interpretação: a cor original do meio é amarelo-palha.
Positivo: alteração do meio para cor de rosa, pink.
Positivo rápido: 1 – 6 horas para Proteus spp.
Positivo tardio: 24 horas a 6 dias ou mais tempo de incubação para algumas cepas de Klebsiella, Enterobacter, Citrobacter, Haemophilus.
Negativo: sem alteração de cor do meio.
Recomendações: não aquecer a solução base da ureia, pois ela pode se decompor. Não deixar o meio em temperatura ambiente pode ocorrer autohidrólise.
4. Produtos para Provas de Identificação
4.1 Prova de Catalase
Princípio: presença, em alguns micro-organismos, da enzima catalase, que decompõe o peróxido de hidrogênio (H2O2) em água e oxigênio, formando bolhas. Para isso, faz-se um esfregaço (não precisa adicionar água na lâmina) e adiciona-se água oxigenada.
Utilidade: para Streptococcus, Staphylococcus, Enterococcus, Listeria, Corynebacterium, Micrococcus, Bacillus, Moraxella catarrhalis. Geralmente utilizada para diferenciar Streptococcus (catalase negativos) de Staphylococcus (catalase positivos).
Interpretação:
Positivo: presença imediata de bolhas e efervescência.
Negativo: ausência de bolhas ou efervescência.
Recomendações: para o crescimento em cultura, evitar o uso de meios contendo sangue, pois os eritrócitos podem produzir reação fraca de catalase, gerando resultados falso-negativos.
4.2 Prova de Coagulase
Princípio: presença, em alguns micro-organismos, da enzima catalase, que reage com o plasma sanguíneo através de um mecanismo similar ao da coagulação normal. Pode ser encontrada em duas formas que possuem diferentes propriedades: coagulase conjugada (prova em lâmina) e coagulase livre (prova em tubo).
Utilidade: diferenciar entre as espécies de Staphylococcus de importância clínica, S. aureus (coagulase positiva), das demais espécies (coagulase negativas).
Interpretação:
A) Coagulase conjugada:
Positiva: precipitado branco e aglutinação dos micro-organismos da suspensão, após 15 segundos, no círculo que contém o plasma.
Negativa: ausência de aglutinação no círculo que contém o plasma.
Controle sem plasma: deverá ser leitoso e uniforme, sem precipitado ou aglutinação, os quais tornam a prova inespecífica, devendo ser repetida a prova em tubo.
B) Coagulase livre:
Positiva: presença de qualquer grau de coágulo.
Negativa: ausência de coágulo.
Recomendações: durante a leitura, inclinar o tubo delicadamente e não agitar, pois pode desmanchar os coágulos parcialmente formados. Recomenda-se o uso de plasma de coelho com EDTA e não recomenda-se o plasma humano, pois este contém quantidades variadas de Fator de Reação com a coagulase e de anticorpos antiestafilococos, podendo dar uma prova falso-negativa.
4.3 Prova de Gelatinase
Princípio: habilidade de alguns micro-organismos de produzir enzimas proteolíticas (gelatinase), que liquefazem/hidrolisam gelatina.
Utilidade: identificar e classificar bactérias fermentadoras.
Interpretação:
Positivo: emulsão de gelatina (cor verde) na porção submersa do filme torna-se transparente (clara).
Negativo: fita permanece verde, emulsão esverdeada permanece na porção submersa do filme.
Recomendações: utilizar filme de Raio X não revelado.
4.4 Prova de Lecitinase
Princípio: cepas produtoras de lecitinase produzem zona opaca ao redor do inoculo.
Utilidade: diferenciação de espécies de Bacillus e de Clostridium.
Interpretação: a cor original do meio é amarela.
Positivo: formação de halo branco ao redor das colônias.
Negativo: ausência de halo, meio fica inalterada.
Recomendações: não usar ovos velhos. Não usar meio vencido.
4.5 Prova de Oxidase
Princípio: produção intracelular da enzima oxidase por algumas bactérias.
Utilidade: ajuda caracterizar espécies de Neisseria e diferenciar não fermentadores (oxidase positivas) de enterobactérias (oxidase negativas). Diferencia algumas bactérias fermentadoras oxidase positiva entre elas Plesiomonas shigelloides, Aeromonas spp. e Vibrio spp.
Interpretação: a cor original meio é branca ou levemente azulada.
Oxidase positiva: produção de cor roxa imediatamente no local da inoculação da bactéria. Não considerar alteração de cor tardia.
Oxidase negativa: não há mudança da cor do papel no local da inoculação da bactéria.
Recomendações: não fazer o teste de colônias de crescimento de meios que contenham glicose, pois a fermentação o inibe a atividade da oxidase, podendo resultar em falso negativo. Não fazer teste de colônias de crescimento de meios seletivos (Mac Conkey, XLD, EMB), mas sim de meios não seletivos (Ágar sangue e Ágar chocolate). Os reagentes para oxidase, se auto oxidam rapidamente com o ar, perdendo a sensibilidade.
4.6 Fermentação de Carboidratos
Princípio: capacidade de alguns micro-organismo fermentarem um determinado carboidrato, enquanto outros não.
Utilidade: identificar e separar espécies de Enterococcus spp., Streptococcus spp. e Staphylococcus coagulase negativa.
Interpretação (meio comercial): a cor original do meio é púrpura ou alaranjado.
Positivo: crescimento bacteriano (turvação do meio) com viragem do indicador para amarelo.
Negativo: ausência de crescimento, o meio permanece com a cor original e sem turvação.
Recomendações: para provas negativas, incubar um período maior (48 horas). Não autoclavar a base com o carboidrato, pois a alta temperatura pode degradá-lo.
4.7 Prova PYR
Princípio: teste enzimático que consiste na hidrólise de um substrato por uma enzima bacteriana, com a liberação de outro substrato, que reage com PYR e é detectado com a formação de uma base de Schiff, de coloração vermelha.
Utilidade: teste presuntivo para identificar Streptococcus beta hemolítico presumível do grupo A de Lancefield (S. pyogenes) e Enterococcus spp., identificação de algumas espécies Staphylococcus coagulase negativa e identificação de bacilos Gram-negativos não fermentadores.
Interpretação:
Positivo: cor vermelho cereja em 1 minuto (após adicionar o reagente de PYR).
Negativo: sem alteração de cor.
Recomendações: para identificações presuntivas do Streptococcus pyogenes ou de Enterococcus spp., confirmar se realmente são cocos Gram-positivos catalase negativos, pois algumas cepas de Staphylococcus spp., Aerococos e Arcanobacterium haemolyticum, podem ser PYR positivos. Raras cepas de Enterococcus spp. podem ser catalase positiva, confirmar com outras provas (como bilis esculina) tratar de enterococo ou não. Não utilizar colônias com crescimento superior a 24 horas, culturas velhas podem dar resultado falso – negativo,e não exceder o tempo de leitura.
4.8 Crescimento a 42 E 44°C
Princípio: capacidade de alguns micro-organismo crescerem em altas temperaturas.
Utilidade: identificação de bacilos Gram-negativos não fermentadores.
Interpretação: a cor original do meio é púrpura.
Positivo: turvação e viragem do indicador de púrpura para amarelo.
Negativo: ausência de turvação e permanência da cor púrpura.
Recomendações: não fazer inoculo muito denso, pode resultar em falsa turvação. Importante o controle da temperatura do banho, com termômetro de máxima e mínima.
4.9 Teste de Motilidade
Princípio: flagelos ocorrem nos bacilos Gram-negativos; poucas formas de cocos são moveis. A bactéria pode conter um ou muitos flagelos e sua localização varia com a espécie da bactéria e com as condições de cultura.
Utilidade: determinar se o micro-organismo é ou não móvel.
Meios associados a outros testes: Meios SIM (Sulfato, Indol, Motilidade), MILI (Motilidade, Indol, Lisina), MIO (Motilidade, Indol, Ornitina) utilizados para testes enterobacterias.Meio motilidade em caldo utilizado para não fermentadores e Enterobacter cloacae (em casos de dúvidas).
Interpretação:
Motilidade positiva: organismos móveis migram pela linha do inoculo e difundem-se no meio, causando turbidez.
Motilidade negativa: bactéria tem um crescimento acentuado apenas ao longo da linha de inoculo.
Recomendações: a temperatura de incubação é extremamente crítica, porque muitos micro-organismos são móveis a 15-25°C e no móveis a 37°C. Se houver suspeita que o micro-organismo pode exibir motilidade em baixa temperatura, inocular dois tubos simultaneamente, um a 35°C e outro a temperatura ambiente 22-25°C. Os testes de motilidade em anaeróbios são difíceis de serem interpretados, sendo significativos apenas os resultados positivos.
4.10 Prova de Tolerância ao NaCl 6,5%
Princípio: verificar a capacidade de alguns micro-organismos crescerem em presença do sal. O meio base utilizado é o BHI caldo, que e um meio nutritivo de uso geral, empregado para o cultivo de muitas bactérias. Esse meio normalmente contém 0,5 % de NaCl e aumenta-se para 6,5 %, tornando um meio semi-seletivo para o desenvolvimento de alguns micro-organismos.
Utilidade: separa Enterococcus spp., que são NaCl 6,5 % positivo dos demais Streptococcus spp., que são NaCl 6,5% negativos. Identificação de bacilos Gram-negativos não fermentadores.
Interpretação: a cor original do meio é amarelo ou purpura, dependendo do uso do indicador na composição.
Positivo: turvação do meio com ou sem viragem do indicador.
Negativo: ausência de crescimento. O meio permanece com a cor original e sem turvação.
Recomendações: para provas negativas com 24 horas de incubação, recomenda-se período de maior (48 horas). Verificar a quantidade de NaCl contido na fórmula do meio de BHI. Não carregar no inoculo, pois o excesso poderá ser interpretado como crescimento e dar resultados falso – positivos. Os Streptococcus beta hemolítico presumível do grupo B de Lancefield (S. agalactiae) e ocasionalmente os Streptococcus beta hemolítico presumível do grupo A de Lancefield (S. pyogenes) podem ser tolerantes ao NaCl 6,5%. Utilizar outras provas para confirmar a identificação destas espécies.
5. Discos para Identificação
5.1 Bacitracina
Princípio: Streptococcus beta hemolítico do grupo A são sensíveis a concentrações baixas de Bacitracina.
Utilidade: identificação presuntiva de Streptococcus beta hemolítico do grupo A (S. pyogenes).
Interpretação:
Positivo (Sensível): presença de qualquer halo ao redor do disco.
Negativo (Resistente): ausência de halo ao redor do disco.
Recomendações: não existem dados disponíveis que indiquem a necessidade de medir os halos de inibição. O inoculo bacteriano deve ser confluente, inoculo muito diluído pode permitir que os Streptococcus não pertencentes ao grupo A pareçam sensíveis a bacitracina.
5.2 Novobiocina
Princípio: separa espécies de Staphylococcus coagulase negativa que podem ser sensíveis ou não à Novobiocina.
Utilidade: separa cepas de Staphylococcus saprophyticcus (Novobiocina resistentes) das demais cepas de Staphylococcus coagulase negativa de importância clínica.
Interpretação:
Resistente: ausência de halo de inibição ou halos igual ou inferior a 15 mm.
Sensível: presença de halo de inibição igual ou superior a 16 mm.
Recomendações: se necessário usar cepas velhas (com crescimento superior a 24 horas), semear em caldo BHI ou TSA e incubar a 37oC até turvar, acertar a turvação na escala 0,5 de MacFarland para fazer o teste. Para cepas isoladas de outros materiais biológicos que não urina, fazer identificação complementar com fermentação de açúcares para confirmar espécie.
5.3 Optoquina
Princípio: optoquina inibe de forma seletiva o crescimento de Streptococcus pneumoniae em concentrações muito baixas (5 μg/mL ou menores). As células do Streptococcus pneumoniae que rodeiam o disco sofrem lise, devido à variação da tensão superficial, e é produzida uma área de inibição.
Utilidade: separa Streptococcus pneumoniae dos demais Streptococcus alfa hemolíticos.
Interpretação:
Positivo (Sensível): disco de 6 mm: halo de inibição de 14 mm ou mais; disco de 10 mm: halo de inibição de 16 mm ou mais.
Negativo (Resistente): disco de 6 mm: halo de inibição inferior a 14 mm ou ausência de halo; disco de 10 mm: halo de inibição inferior a 16 mm ou ausência de halo.
Recomendações: a optoquina pode inibir outros Streptococcus do grupo viridans, mas apenas em concentrações muito elevadas.
Referência:
Descrição dos Meios de Cultura Empregados nos Exames Microbiológicos, disponível em http://www.anvisa.gov.br/servicosaude/manuais/microbiologia/mod_4_2004.pdf, acesso em 21/01/2015.
16 notes
·
View notes
Text
Contadores Hematológicos Automatizados
Princípios Operacionais
Os mais recentes contadores de células sanguíneas totalmente automatizados aspiram e diluem uma amostra de sangue e determinam de 8 a 46 parâmetros relacionados com os eritrócitos, os leucócitos e as plaquetas. Muitos identificam a amostra (p.ex. pela leitura do código de barra), homogeneizam e transportam a amostra para a agulha aspiradora, que em geral perfura a tampa, verificando se o volume foi adequado e se não há coágulos. Alguns são conectados a uma máquina automática de distender e corar lâminas.
Os eritrócitos, os leucócitos e as plaquetas podem ser contados e medidos por impedância elétrica ou por dispersão de luz. Com exceção da dosagem da Hb, todos os parâmetros dependem de contagem e de medida de partículas. Os instrumentos automatizados possuem pelo menos dois canais. Em um deles é adicionado um diluente e são contados e medidos os eritrócitos e as plaquetas. No outro, é adicionado um agente lítico com o diluente, para reduzir os eritrócitos a estromas, deixando intactos os leucócitos para a contagem e produzindo uma solução na qual se pode dosar a hemoglobina. São necessários mais canais para proceder à contagem diferencial dos leucócitos, com frequência dependente da avaliação das células pela tecnologia de impedância com corrente elétrica de diversas frequências, pela dispersão e pela absorvância da luz. Para a contagem de reticulócitos, pode ser necessário um outro canal ou um outro instrumento.
Os instrumentos automatizados não conseguem identificar todas as anormalidades significativas identificadas pelo observador humano. Eles são projetados para fornecer contagens sanguíneas exatas e reprodutíveis em espécimes normais ou que apresentem apenas anormalidades numéricas bem como para alertar o operador do instrumento quanto a características inusitadas que possam dar origem a determinações inexatas ou que exijam a revisão de uma distensão sanguínea. Os resultados apresentarão “alarme” (flaging) quando a amostra de sangue contiver: (a) células blásticas, granulócitos imaturos, eritroblastos ou linfócitos atípicos; (b) plaquetas gigantes, agregadas ou outro que impeça a separação da população de eritrócitos da de plaquetas e (c) anormalidade que possa originar resultados espúrios.
Um desafio aos instrumentos automáticos é a produção de índices hematimétricos exatos e a dosagem de Hb em pacientes de que receberam substitutos de sangue derivados de Hb. Isso é possível com instrumentos Bayer que medem individualmente o tamanho e a concentração de hemoglobina dos eritrócitos.
Instrumentos Beckman-Coulter
Advento da Contagem por Impedância, ou seja, por obstrução da passagem de corrente elétrica. As células sanguíneas são péssimas condutoras de eletricidade e, quando colocadas em um meio condutor, que passa por uma pequena abertura por onde circula uma corrente elétrica, há um aumento mensurável da impedância elétrica na abertura, à medida que cada célula passa. Assim, são contadas e medidas as células a partir dos impulsos elétricos que geram. Cada impulso é proporcional ao volume celular e tem sua amplitude, sua duração e sua forma influenciadas pela forma celular. As células com maior deformidade, que podem alongar-se quando passam pela abertura em resposta às tensões do fluxo, parecem menores, enquanto as células rígidas parecem maiores do que são. Além disso, a deformidade é uma função da concentração de Hb dentro da célula.
Alguns impulsos aberrantes podem ocorrer em decorrência da passagem das células pela abertura fora do centro, produzindo impulsos maiores do que são, ou de células que voltam a circular pela borda do campo elétrico, produzindo impulsos menores do que os produzidos por células semelhantes ao passarem pela abertura; um eritrócito recirculante pode produzir um impulso semelhante ao de uma plaqueta passando pela abertura. Células que passam pela abertura ao mesmo tempo, ou quase ao mesmo tempo, são contadas e medidas como uma única célula, sendo a falta de exatidão introduzida, corrigida (correção de coincidência). Impulsos aberrantes podem ser editados eletronicamente. O fluxo centrado em uma bainha de solvente, ou o enfoque hidrodinâmico, podem orientar as células para o centro da abertura, reduzindo os problemas produzidos pela coincidência e pelos impulsos aberrantes. Tanto o fluxo centrado quanto o de varredura atrás da abertura evitam a recirculação de células. Os contadores de impedância produzem determinações muito reprodutíveis do volume celular e do conteúdo e concentração de Hb. Assim, os Instrumentos Coulter contam e medem os eritrócitos, os leucócitos e as plaquetas pela tecnologia de impedância e são fornecidos histogramas da distribuição por volume dos eritrócitos, das plaquetas e dos leucócitos.
Canal 1: os eritrócitos e as plaquetas são contados e medidos no mesmo canal. A variação do tamanho dos eritrócitos é indicada pela amplitude de distribuição volumétrica dos eritrócitos (RDW). O parâmetro equivalente das plaquetas é a amplitude de distribuição volumétrica das plaquetas (PDW). Com frequência há sobreposição de tamanho entre os eritrócitos pequenos e as plaquetas grandes, que podem ser distinguidas por um limiar fixo (p.ex. em 20 fL), por um limiar móvel, ou ainda serem utilizados os dados das contagens entre dois limiares (p.ex. 2 e 20 fL), para estabelecer uma curva que é extrapolada, de modo que as plaquetas que caem fora desses limiares (p.ex. entre 0 e 70 fL) também sejam incluídas na contagem. Da determinação do VCM e da contagem de eritrócitos deriva-se o HTC; da Hb e da contagem de eritrócitos, a HCM; da Hb, da contagem de eritrócitos e do VCM, a CHCM.
Canal 2: a hemoglobina e os leucócitos são contados em outro canal. Anteriormente, a Hb era determinada por um método modificado de cianometemoglobina que, subsequentemente, foi substituído por um método que usa reagente isento de cianeto. Após a lise dos eritrócitos por ação de um agente lítico com o diluente, ocorre a contagem de leucócitos, que inclui alguns, mas não necessariamente todos, os eritroblastos encontrados.
Canal 3: contagem diferencial de leucócitos após remoção parcial do citoplasma. Os instrumentos Coulter primitivos (a série S Plus e o STKR) produzem uma contagem diferencial em três partes, baseada apenas na impedância (que depende do volume celular), resultando nas categorias de leucócitos: (1) granulócitos, (2) linfócitos e (3) células mononucleares. Os últimos instrumentos Coulter totalmente automatizados (Coulter STKS, MAXM, HmX, Gen S e LH750) fornecem uma contagem diferencial em cinco tipos celulares, por meio de três medições simultâneas em cada célula: (1) impedância com corrente eletromagnética de baixa frequência (que depende do volume celular); (2) condutividade com corrente eletromagnética de alta frequência ou radiofrequência (que depende da estrutura interna da célula, como densidade núcleo-citoplasma, densidade nuclear e granularidade) e (3) dispersão frontal da luz em 10 a 70º quando as células passam por um feixe de laser (que depende da estrutura, da forma e da reflexividade da célula). Em instrumentos recentes (p.ex. Gen S e LH750), o software permite uma correção de acordo com a influência do volume celular, da condutividade, que passa a ser chamada de opacidade, e da dispersão, que passa a ser chamada de dispersão luminosa rotada. A abreviação VCS – volume, condutividade, dispersão (scatter) – passa a ser usada. São discriminadas cinco populações pela análise tridimensional dos conglomerados (clusters) de células, com base no volume celular, na opacidade e na dispersão luminosa rotada, plotando-se o volume celular contra cada uma das três funções discriminantes: tamanho x função discriminante 1 (derivada da dispersão de luz): separa as células em (1) neutrófilos, (2) eosinófilos, (3) monócitos, (4) linfócitos mais basófilos; tamanho x função discriminante 2 (baseada na condutividade com corrente eletromagnética de alta frequência): separa as células em (1) linfócitos, (2) monócitos, (3) granulócitos; tamanho x função discriminante 3 (obtida pela remoção específica (gating) dos neutrófilos e dos eosinófilos): mostra os basófilos como um conglomerado separado dos linfócitos e dos monócitos. Além desses, há um scatter-plot tridimensional multicolorido.
Canal 4: ainda pode haver o canal de reticulócitos.
Informações sobre os instrumentos Beckman-Coulter estão disponíveis no website da empresa, www.beckman.com.
Instrumentos Sysmex
Também utilizam contagem por impedância, produzindo parâmetros similares, incluindo histogramas da distribuição do volume dos eritrócitos, dos leucócitos e das plaquetas (figura 1) e contagem diferencial em três tipos celulares ou, com tecnologia adicional, cinco ou seis tipos celulares.
Figura 1. Histogramas de parâmetros determinados por impedância. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
A contagem diferencial dos leucócitos em três tipos celulares separa as células em: (1) linfócitos, (2) neutrófilos, (3) Eosinófilos mais Basófilos mais Monócitos (figura 2).
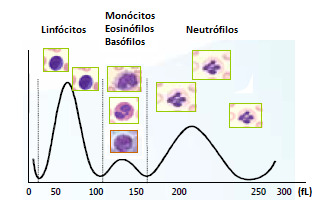
Figura 2. Histograma da contagem diferencial dos leucócitos em três grupos por impedância. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
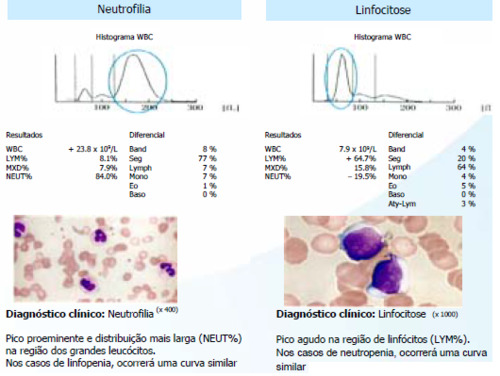
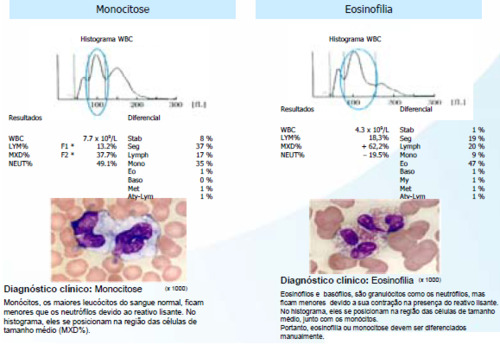
Figura 3. Diagnóstico através do histograma da contagem diferencial dos leucócitos em três grupos por impedância e diagnóstico clínico por microscopia. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
Com tecnologia adicional, a contagem diferencial de leucócitos passou a separar as células em cinco tipos celulares. O Sysmex XE-2100 incorpora citometria de fluxo com fluorescência a um instrumento de múltiplos canais, que incluem laser, corrente contínua (para medidas de impedância) e corrente em radiofrequência (para determinar a estrutura interna das células).
Canal 1: dosagem de hemoglobina, usando um agente lítico potente e um reagente isento de cianeto (laurel-sulfato), que é atóxico, ecologicamente correto e minimiza os interferentes em amostras com lipemia, com leucocitose ou com nível de proteínas elevadas. O canal da Hb separado do canal da contagem dos leucócitos permite o emprego de um agente lítico forte, que impede que as altas contagens de leucócitos interfiram nas dosagens de Hb.
Canal 2: os eritrócitos e as plaquetas também são contados e medidos no mesmo canal, através de impedância em um fluxo com foco hidrodinâmico. Além dos parâmetros eritrocíticos usuais, são fornecidos volume plaquetário médio (MPV), amplitude de distribuição das plaquetas (PDW) e percentagem de plaquetas grandes (platelet large cell ratio – P-LCR, plaquetas maiores de 12 fL). Pode haver aumento de percentagem de P-LCR em pacientes com hiperlipidemias, o qual poderia causar aumento de risco de trombose, enquanto pode haver aumento de MPV, PDW e P-LCR nos pacientes com púrpura trombocitopênica auto-imune.
Canal 3: fórmula diferencial em que são medidas, após interação com um corante fluorescente: a dispersão lateral da luz (SSC), indicativa da estrutura interna da célula; a dispersão frontal da luz (FSC), indicativa do tamanho celular; e a intensidade da fluorescência (SFL), indicativa do tamanho do núcleo. São identificados (1) neutrófilos, (2) eosinófilos, (3) linfócitos e (4) monócitos. Granulócitos imaturos também são contados nesse canal.
Canal 4: medição dos basófilos, pois lisa todas as células exceto estas, diferenciando-as dos outros leucócitos através da dispersão da luz frontal e lateral.
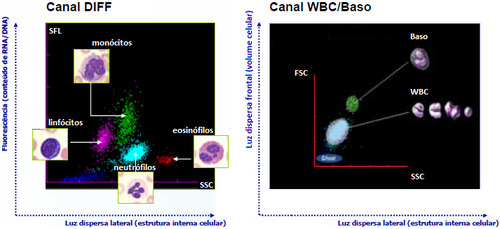
Figura 4. Gráficos de dispersão dos canais DIFF e WBC/BASO por citometria de fluxo fluorescente pelos instrumentos XE-2100 Plus/D e XT-1800/2000, com o posicionamento celular para uma população normal. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
Canal 5: canal NRBC, no qual há medição dos eritroblastos, após sua lise e interação com um corante fluorescente, diferenciando-os dos leucócitos e dos estromas de eritrócitos pela intensidade de fluorescência e pela dispersão frontal da luz. Corrige automaticamente as contagens de leucócitos. Os eritroblastos são menos fluorescentes e dispersam menos luz do que os leucócitos. A persistência de eritroblastos no sangue periférico após transplante de células-tronco é significativa para pior prognóstico.
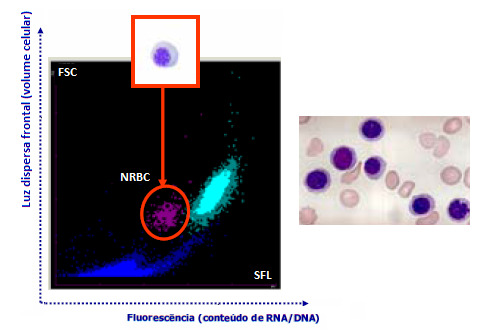
Figura 5. Gráfico do canal de contagem de eritroblastos por citometria de fluxo fluorescente. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
Canal 6: canal IMI(immature myeloid information), com a medição dos granulócitos imaturos, que diferenciam-se dos leucócitos maduros após lise diferencial e análise dos grupos por impedância e corrente de radiofrequência. A contagem absoluta de células primitivas hematopoiéticas (HPC) é uma determinação útil para o momento ótimo para a colheita de células-tronco no sangue periférico, além de predizer quando é vantajoso fazer a determinação mais lenta e dispendiosa de células CD34+.

Figura 6. Gráfico do canal IMI(immature myeloid information), com a medição dos granulócitos imaturos por citometria de fluxo fluorescente. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
Canal 7: canal RET, onde há medição dos reticulócitos e das plaquetas ópticas, com a contagem de plaquetas imaturas (plaquetas reticuladas). Há aumento da fração de plaquetas imaturas em turnover plaquetário acelerado, como na púrpura trombocitopênica trombótica e na hipertensão associada à gravidez. O canal de reticulócitos também pode ser usado para contar e monitorizar fragmentos eritrocitários em pacientes com anemia hemolítica microangiopática.
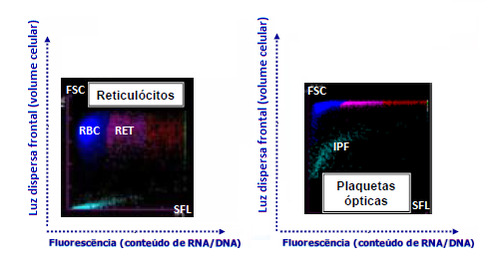
Figura 7. Gráfico do canal RET, com a medição dos reticulócitos (RET) e das plaquetas imaturas (IPF) por citometria de fluxo fluorescente. Adaptado de http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf , acesso em 14/01/2015.
Informações sobre os instrumentos Sysmex estão disponíveis no website da empresa, www.sysmex.com.
Instrumentos Bayer
Os instrumentos da Bayer contam e medem as células por dispersão de luz, ao contrário dos instrumentos já vistos, que utilizam a impedância elétrica. Uma célula, ao passar através de um feixe luminoso, dispersa a luz, que pode ser detectada por sensores fotópticos dispostos lateralmente ao feixe. O grau de dispersão relaciona-se com o tamanho celular, de modo que as células podem ser contadas e medidas. Colocando-se um detector frontalmente ao feixe, pode ser medida também a absorvância da luz. O feixe luminoso pode ser de luz branca ou de laser coerente de grande intensidade, este com qualidade óptica superior. O detector pode ser um fotomultiplicador ou um fotodiodo, que convertem a luz em impulsos elétricos acumulados e contados.
A série H.1 conta e mede as células utilizando a luz branca para os leucócitos e o laser para os eritrócitos e as plaquetas. Os eritrócitos são convertidos de modo isovolumétrico em esferas, de modo que a dispersão da luz não seja influenciada pela forma da célula. As células passam por um raio laser, e a luz dispersada frontalmente é medida em diferentes ângulos, um estreito (2 a 3º) e um mais largo (5 a 15º), cuja comparação permite a computadorização do tamanho e da concentração da hemoglobina das células, uma a uma. São fornecidos histogramas da distribuição das células por volume, que permite a derivação do VCM, da RDW e do HCT, e por concentração de hemoglobina, que permite a derivação da média das concentrações corpusculares de Hb (MCCH) e da amplitude de distribuição de Hb (HDW). A hemoglobina é determinada por uma modificação da metodologia da cianometemoglobina, e a HCM e a CHCM são computadas a partir da hemoglobina, da contagem de eritrócitos e do VCM. A MCCH e a CHCM representam a concentração média da hemoglobina em uma célula e devem fornecer o mesmo resultado. Medidas similares de dispersão de luz em dois ângulos diferentes permitem contar e medir as plaquetas (contagem de plaquetas e VPM), além de serem computados o plaquetócrito e o PDW.
Os instrumentos da série H.1 fornecem determinações exatas de VCM, HCT e CHCM, concordantes com os métodos de referência, conseguindo corrigir a inexatidão dos primeiros instrumentos de dispersão de luz, nos quais a dispersão luminosa era influenciada pela concentração da Hb e pelo tamanho celular, e as inerentes aos contadores por impedância, nos quais a sombra elétrica era influenciada pela deformidade e pelo tamanho celular. Não são medidas com exatidão as células que não podem ser convertidas em esferas isovolumétricas, como as células falciformes, por exemplo.
A contagem diferencial da série H.1 deriva de dois canais. O canal da peroxidase, que utiliza a luz branca, incorporando uma reação citoquímica na qual a peroxidase dos neutrófilos, dos eosinófilos e dos monócitos age sobre um substrato, produzindo um produto negro, que absorve luz. A dispersão da luz (proporcional ao volume celular) é plotada contra a absorvância da luz (proporcional à intensidade da reação de peroxidase). São formados quatro conglomerados: (1) neutrófilos, (2) eosinófilos, (3) monócitos e (4) linfócitos mais basófilos, separados por uma combinação de limiares fixos e móveis. Há outro conglomerado de células peroxidase-negativas e maiores do que a maioria dos linfócitos, as “células grandes não-coradas” (LUC). O canal basófilo/lobularidade é onde os basófilos são distinguidos dos demais leucócitos pela sua resistência à perda do citoplasma frente a um agente lítico em meio ácido, de modo que, medidos por dispersão frontal da luz, são maiores que os resíduos sem citoplasma das demais células. Neste canal também é detectada a presença de blastos, em que a dispersão frontal da luz (proporcional ao tamanho celular) é plotada contra a dispersão da luz em grande ângulo (medida do aumento da densidade nuclear e da lobulação). Os blastos são detectados como uma população com densidade nuclear anormalmente baixa. Além disso, o índice de lobularidade (LI) é uma determinação das células que produzem muita dispersão de luz em ângulo grande (neutrófilos lobulados) e das que produzem menos dispersão (células mononucleares, granulócitos imaturos e blastos).
O instrumento Advia 120 opera nos mesmos princípios, porém, o número total de células nucleadas é fornecido pelo canal basófilo/lobularidade em vez de pelo canal da peroxidase. O instrumento Advia 2120 incorpora um método de dosagem de hemoglobina isento de cianeto, contagem de eritroblastos, correção do CTCN para a contagem de leucócitos e um distensor de lâminas, com ajuste automático pelo hematócrito e pela contagem de leucócitos.
Instrumentos Abbott (Cell-Dyn)
O Cell-Dyn 3500 (Abbott diagnostics) é um instrumento automático de múltiplos canais que utiliza tanto a dispersão de laser quanto a tecnologia de impedância. A hemoglobina é determinada como cianometemoglobina. Os eritrócitos, os leucócitos e as plaquetas são contados e medidos por impedância, depois da remoção do citoplasma dos leucócitos. São fornecidos histogramas da distribuição por volume celular.
A contagem dos leucócitos também é feita por um canal de dispersão de laser, que fornece uma fórmula leucocitária em cinco partes. Os leucócitos, praticamente íntegros, são dirigidos hidrodinamicamente para passarem em fila única através do feixe laser. Nesse canal, os eritrócitos tornam-se transparentes, porque seu índice de refração é o mesmo do reagente da bainha do fluido. São analisados quatro padrões de dispersão luminosa: (1) Dispersão luminosa frontal a 1 a 3º (referida como dispersão a 0º), dependente principalmente do tamanho celular; (2) Dispersão luminosa em ângulo estreito, de 7 a 11º (chamado de dispersão a 10º), dependente da estrutura e da complexidade celular; (3) Dispersão ortogonal de luz totalmente polarizada a 70º a 100º (chamada de dispersão a 90º); (4) Dispersão ortogonal de luz despolarizada a 70º a 100º (chamada de dispersão a 90º D).
São fornecidos gráficos de dispersão das populações de leucócitos, que são inicialmente separadas em (1) granulócitos e (2) células mononucleares, com base na lobularidade e na complexidade. Em seguida, os granulócitos são separados em (1) eosinófilos e (2) neutrófilos, com base na capacidade única dos eosinófilos de despolarizarem a luz. Depois, as células mononucleares são separadas em (3) monócitos, (4) linfócitos e (5) basófilos degranulados (os grânulos basofílicos são solúveis no reagente da bainha fluida), com base no tamanho e na complexidade celulares. Finalmente, são indicadas as cinco populações (codificadas pela cor) em uma plotagem da lobularidade contra o tamanho. Células com características anômalas geram alarmes para blastos, linfócitos atípicos, eritroblastos e granulócitos imaturos. A contagem de leucócitos por duas tecnologias serve como um mecanismo interno de controle de qualidade.
O Cell-Dyn 4000 incorpora a contagem automática de reticulócitos e de eritroblastos. O Cell-Dyn Sapphire incorpora quatro detectores ópticos para luz polarizada e despolarizada e três detectores de fluorescência. Neste, o tipo de laser e os reagentes diferem dos usados nos instrumentos anteriores, mas os princípios são os mesmos.
Informações sobre os instrumentos Abbott estão disponíveis no website da empresa, www.abbottdiagnostics.com.
Instrumentos Horiba ABX
Os eritrócitos, os leucócitos e as plaquetas são contados e medidos por tecnologia de impedância, sendo fornecidos histogramas da distribuição do volume. O HCT é determinado pela integração da amplitude dos sinais elétricos gerados pelos eritrócitos, com correção da coincidência. As plaquetas são diferenciadas dos eritrócitos por um limite flutuante entre 18 3 25 fL. A hemoglobina é dosada por cianometemoglobina ou por oxidação do ferro do heme, seguida por estabilização, para produção de substâncias cromogênicas passíveis de dosagem. A contagem diferencial baseia-se em dois canais. Em um canal, após interação das células com negro-clorazol E (o princípio ativo do Sudan black B), são feitas determinações de absorvância e de impedância. O corante cora intensamente os grânulos dos eosinófilos, um pouco menos os dos neutrófilos e fracamente os dos monócitos; a absorvância de luz das células coradas é determinada pela intensidade de coloração dos grânulos e pelo grau de complexidade do núcleo. Em um segundo canal, os basófilos, após desnudamento diferencial do citoplasma, são diferenciados dos demais leucócitos por medidas de impedância. As diversas populações de leucócitos são dispostas em gráfico correlacionando absorvância luminosa contra impedância e são identificadas com limiares móveis.
Linfócitos atípicos são contados separadamente, mas também são incluídos na contagem total de linfócitos, ao contrário dos instrumentos Bayer, em que as células grandes não-coradas são contadas separadamente e excluídas da contagem de linfócitos. Células grandes imaturas são contadas separadamente, mas também são incluídas ou na categoria dos neutrófilos ou dos monócitos, dependendo da absorvância. A categoria dos linfócitos atípicos pode incluir células da mononucleose infecciosa, células linfomatosas, células da leucemia linfocítica crônica, blastos pequenos e plasmócitos. A categoria das células grandes imaturas pode incluir mieloblastos, monoblastos, promielócitos, mielócitos, metamielócitos, linfoblastos e células linfomatosas. O Pentra DX 120 também oferece contagem de reticulócitos.
Informações sobre instrumentos Pentra estão disponíveis em www.horibaax.com.
Contadores Diferenciais Automatizados por Identificação de Imagem
A Cella Vision AB produziu um contador diferencial automatizado por identificação de imagem, o Diffmaster Octavia, baseado na microscopia de distensões de sangue coradas com MGG ou Wright-Giemsa, interpretado por um programa de computador empregando neural networks. A identificação das células pode ser confirmada visualmente e, se necessário, alterada.
Informações estão disponíveis no site www.cellavision.com.
Referências
Bain, B., J. Células Sanguíneas: um guia prático. Tradução de Renato Failace.4 ed. Porto Alegre: Artmed, 2007. 487 p.
Willrich, V. Novas Aplicações em Hematologia. Disponível em http://www.labvernerwillrich.com.br/2008/material_cientifico/aplicacoes_em_hematologia_sysmex.pdf, acesso em 16/01/2015.
4 notes
·
View notes
Text
Técnicas de Contagem de Glóbulos
No passado, as contagens de glóbulos e as demais determinações do hemograma eram feitas por técnicas manuais, lentas e trabalhosas. As determinações mais usadas eram: dosagem de hemoglobina (HB), hematócrito (HCT) e contagem de leucócitos (L). A contagem de eritrócitos (E) era feita só ocasionalmente e, em geral, para permitir uma estimativa do volume corpuscular, correlacionando-a ao HCT. As plaquetas eram contadas apenas quando havia óbvia necessidade clínica. Das determinações relativas à série vermelha, eram calculados os índices hematimétricos: volume corpuscular médio (VCM), hemoglobina corpuscular média (HCM) e concentração de hemoglobina corpuscular média (CHCM), com as seguintes fórmulas:
VCM (fL) = HCT (%) x 10
E (milhões/mL)
HCM (pg) = HB (g/dL) x 10
E (milhões/mL)
CHCM (g/dL) = HB (g/dL) x 100
HCT (%)
Hoje, essas e outras determinações são realizadas em minutos, em instrumentos automatizados ou semi-automatizados. As determinações são reprodutíveis e, se os instrumentos estiverem aferidos e o sangue não tiver características incomuns, são também exatas (acuradas). Porém, apesar do uso generalizado dos instrumentos automatizados, continuam úteis as técnicas manuais, tanto como métodos de referência quanto na investigação de amostras de sangue de resultados anômalos nos instrumentos automatizados.
Técnicas Básicas
1. Dosagem de Hemoglobina (HB)
Antigamente: HB era medida por colorimetria, com resultado inicialmente expresso em percentagem relativa a um “100% normal”, depois modificado para a expressão atual massa/volume.
Atualmente: HB é medida através da densidade óptica (ou absorvância) por espectrofotômetro em comprimento de onda apropriado. É expressa em g/dL (massa por volume) ou em mmol/L (concentração molar), cujo fator de conversão é 0,06206, ou seja, uma HB de 120 g/dL = 120 x 0,06206 mmol/L = 7,45 mmol/L. Quando se expressa HB em concentração molar, também devem ser expressas assim a HCM e a CHCM.
Adiciona-se um volume predeterminado de sangue total, cuidadosamente homogeneizado, a um diluente que lisa os eritrócitos, pela hipotonicidade ou pela presença de um detergente lítico não iônico, produzindo uma solução de hemoglobina. O ICSH (International Council for Standardization in Haematology) recomenda um método de referência no qual a hemoglobina é convertida em cianometemoglobina. Assim, a hemoglobina, a metemoglobina e a carboxiemoglobina são convertidas em cianometemoglobina, de modo que todas estão incluídas na dosagem. Das formas presentes no sangue, apenas a sulfemoglobina, geralmente em quantidades desprezíveis, não é convertida em cianometemoglobina, embora a carboxiemoglobina seja convertida mais lentamente que as demais. O método de referência exige a adição de um diluente que contenha: (a) cianeto e ferrocianeto de potássio, para a conversão em metemoglobina; (b) fosfato de potássio diidrogenado, para baixar o pH, acelerar a reação e permitir a leitura da absorbância óptica em três minutos e não em 10 a 15 minutos e (c) detergente não-aniônico, para acelerar a hemólise e reduzir a turvação devido a precipitação de lipoproteínas e, em menor grau, dos eritrócitos, como consequência do baixo pH. A absorvância da luz pela solução é determinada em 540 nm, em espectrofotômetro. Como nesse comprimento de onda a absorvância do diluente é zero, ele ou a água podem ser utilizados como branco. Para conferir o comprimento de onda da luz produzida pelo instrumento e a escala de absorvância, costuma-se calibrá-lo com uma solução de referência de cianometemoglobina.
Na rotina, HB é geralmente dosada com um fotômetro que produz luz num comprimento de onda de aproximadamente 540 nm pelo uso de um filtro amarelo-verde Ilford 625. A luz, que atravessa a solução, é detectada pela célula fotoelétrica, e a escala do instrumento apresenta-a como absorvância ou transmitância. A comparação da leitura do instrumento com a da solução de referência permite calcular a HB com uma curva-padrão ou com uma tabela de conversão, sendo indispensável uma solução de referência de cianometemoglobina para verificar a exatidão desse tipo de instrumento.
Os espectrofotômetros e os fotômetros são sensíveis à turvação, que pode ser provocada por contagem elevada de leucócitos, altas concentrações de lipídeos ou de proteínas plasmáticas ou presença de eritrócitos não-lisados, causando a elevação espúria da taxa de HB. Quando a taxa de leucócitos for muito alta, deve-se centrifugar ou filtrar a solução antes da leitura. Quando na presença de hiperlipidemia, pode-se preparar um branco do diluente com o plasma do paciente ou remover o lipídeo por extração com dietil-éter e centrifugação. Quando houver taxa elevada de proteínas plasmáticas (presença de paraproteína ou hipergamaglobulinemia policlonal por infecção ou inflamação crônica severa), adiciona-se carbonato de potássio ou uma gota de solução de amônia a 25%. Quando não ocorrer a lise no diluente, por presença de células em alvo de hepatopatias ou de eritrócitos contendo HB S ou C, a diluição 1:1 em água destilada garante lise completa das células osmoticamente resistentes.
O método cianometemoglobina foi modificado para ser aplicado em instrumentos automatizados, utilizando-se diversos agentes líticos e leitura da absorvância em menor tempo ou em comprimento de onda diferente.
2. Hematócrito (HCT)
É a medida da fração ocupada pelos eritrócitos em uma coluna de sangue centrifugado; uma pequena parte desse volume corresponde ao plasma retido entre as células.
Antigamente: HCT era expresso uma percentagem. Utiliza-se a expressão packed cell volume (PVC) – volume das células compactadas – para as determinações feitas pelas técnicas tradicionais de centrifugação.
Atualmente: HCT passou também a ser expresso como uma fração decimal (volume/volume) do total centrifugado (coluna total). A expressão “HCT” é utilizada para as estimativas obtidas por instrumentos automatizados. O micro-hematócrito é o método utilizado, que pode ser combinado com a HB para se obter uma estimativa da CHCM, e usado para calibrar os contadores automatizados.
Aspira-se, por capilaridade, um pequeno volume de sangue em um tubo capilar não graduado, com 75mm de comprimento e 1,2mm de diâmetro. Sela-se a extremidade distante da coluna de sangue pelo calor ou com massa de modelar. Centrifuga-se por 5 a 10 minutos (preconiza-se 5 min e, se a amostra for policitêmica, mais 3 min) em alta rotação (entre 10000 e 15000g) em um centrifugador pequeno, específico para este fim. A coluna de sangue separa-se em eritrócitos e plasma, com uma pequena camada de leucócitos e plaquetas na interface (buffy coat). O HCT é lido visualmente e em escala apropriada, excluindo-se da leitura a camada leucoplaquetária. O micro- HCT costuma ser determinado em sangue venoso anticoagulado com EDTA, mas também pode ser usado sangue capilar, se coletado em tubo de micro- HCT com interior revestido de heparina (Ul). Tubos plásticos (policarbonato) são mais seguros que os de vidro.
Algumas desvantagens desse método são a facilidade de quebra dos tubos capilares com risco de ferimentos e transmissão viral, a falta de exatidão e reprodutibilidade no micro-HCT e a difícil leitura correta em decorrência das pequenas dimensões do tubo. Pode-se aumentar a precisão do micro-HCT fazendo-se três determinações na mesma amostra e tirando-se a média; isso é necessário quando o micro-HCT é feito com a finalidade de calibração de um instrumento automatizado; nesse caso, recomenda-se, também oxigenar bem o sangue antes de encher os tubos capilares, pois a desoxigenação aumenta o resultado.
Houve tentativas de aumentar a exatidão do micro-HCT, corrigindo-se o resultado pela subtração do volume de plasma retido, o que tornaria também mais exata a estimativa do VCM. Na rotina laboratorial, essa correção é impraticável; uma circunstância na qual se considera, no entanto, é na estimativa da massa eritroide total pelo micro-HCT.
O método de referência proposto pelo ICSH baseia-se na determinação da HB no sangue total e na massa de eritrócitos compactados pela centrifugação na centrífuga de micro-HCT. A dosagem é feita em células compactadas obtidas do meio da coluna, onde a retenção de plasma é mínima.
HCT referência = HB do sangue total
HB dos eritrócitos compactados
Com o uso atual de instrumentos automatizados, computa-se o HCT a partir do número e do tamanho dos impulsos elétricos gerados pela passagem dos eritrócitos por um sensor.
3. Contagem de Eritrócitos (E)
Antigamente: eritrócitos eram contados à microscopia de uma amostra de sangue, cuidadosamente diluída, em uma câmara de volume conhecido (hemocitômetro).
Atualmente: eritrócitos determinados por contadores de impedância semi-automatizados de canal único ou contadores totalmente automatizados.
A contagem de eritrócitos em contadores de impedância de canal único são mais precisos e demandam menor tempo de trabalho do que as realizadas em câmaras de contagem. O resultado desse método de contagem de eritrócitos pode ser utilizado com a HB e o HCT manuais para o cálculo do VCM e da HCM, que também serão mais exatos. Uma vez estabelecido o conjunto exato de limiares, os instrumentos de impedância semi-automatizados de canal único não precisam de calibração. As contagens de células fornecidas por eles não variam linearmente com a concentração celular, pois seu aumento amplia a chance de passarem duas células simultaneamente pela abertura (coincidência); alguns instrumentos fazem a correção automática. Os leucócitos são também incluídos na contagem mas, como os eritrócitos são, pelo menos, 100 vezes mais numerosos, a inexatidão por essa razão não costuma ser grande.
As contagens de eritrócitos pelos instrumentos de impedância semi-automatizados de canal único podem ser usadas para calibrar os contadores totalmente automatizados, os quais contam os impulsos elétricos gerados pela passagem dos eritrócitos por um sensor.
O método de referência para a contagem de eritrócitos emprega um método semi-automático de impedância de um canal, com acurácia comprovada pela extrapolação de contagens em diluições seriadas.
Parâmetros eritroides derivados: índices hematimétricos: com a determinação da HB, do HCT e dos E, é possível calcular o VCM, a HCM e a CHCM. Os parâmetros medidos pela máquina e os derivados, que descrevem as características dos eritrócitos, são designados coletivamente como índices hematimétricos.
4. Contagem de Leucócitos (L)
Antigamente: leucócitos eram contados à microscopia de uma amostra de sangue, diluída em solução que lisava os eritrócitos e corava o núcleo dos leucócitos, no mesmo hemocitômetro usado para a contagem de eritrócitos.
Atualmente: leucócitos também podem ser contados no sangue total diluído em solução hemolítica nos contadores de impedância semi-automatizados de canal único ou em contadores totalmente automatizados, pela tecnologia de impedância ou de dispersão de luz. Contadores automáticos são inadequados para contar números muito baixos de leucócitos, sendo necessário exame em citômetro de fluxo, corando-se os núcleos dos leucócitos com corante para DNA.
O método de referência para contagem de leucócitos usa um instrumento semi-automático, de um só canal de impedância, com correção da coincidência feita pela extrapolação a partir de contagens em diluições seriadas. O limiar inferior é ajustado entre o ruído produzido pelos estromas de eritrócitos e o sinal dos leucócitos.
5. Contagem de Plaquetas
Antigamente: plaquetas contadas no hemocitômetro, em sangue total diluído (com eritrócitos intactos ou lisados) ou em plasma rico em plaquetas (preparado por sedimentação ou centrifugação). Se houver plaquetas excepcionalmente grandes, prefere-se o método do sangue total, mas nos casos de baixas contagens, prefere-se utilizar o plasma rico em plaquetas. Pode-se distinguir os eritrócitos das plaquetas pois estas são pequenas, com forma mais oval e com contorno irregular. O uso do diluente oxalato de amônio, que lisa os eritrócitos, produz uma contagem mais alta e exata do que o formol-citrato, que deixa os eritrócitos intactos. As plaquetas podem ser vistas na câmara de contagem com microscópio óptico, em que se pode acrescentar azul-brilhante-de-cresil ao diluente, o qual cora as plaquetas em azul-claro, facilitando a identificação, ou com contraste de fases, no qual é mais fácil identificá-las.
Atualmente: plaquetas podem ser contadas por métodos semi-automatizados, nos contadores de impedância, depois de preparação de plasma rico em plaquetas, ou por contadores totalmente automatizados.
No uso do método semi-automatizado, há necessidade de correção de coincidência e do uso de dois limiares, para excluir tanto restos celulares como contaminação por eritrócitos e leucócitos. Os laboratórios que tenham equipamento automático para contagem de eritrócitos, mas não de plaquetas, podem estimá-las indiretamente, calculando a relação eritrócitos/plaquetas em uma distensão corada.
A única maneira satisfatória de contar plaquetas, com a frequência exigida pela prática médica atual, no entanto, é com contadores totalmente automatizados, por tecnologia de impedância, de dispersão de luz ou de fluorescência óptica. Em refinamento mais recente, pode ser incorporado um anticorpo monoclonal a uma glicoproteína das plaquetas, de modo a distingui-las com segurança de outras partículas. As contagens costumam ser reprodutíveis mesmo quando há trombocitopenia. Na amostra de pacientes com plaquetas gigantes, que não podem ser distinguidas dos eritrócitos na maioria dos contadores automáticos, é preciso fazer as contagens no hemocitômetro.
Há várias propostas como método de referência. Uma delas correlaciona as plaquetas aos eritrócitos, em um instrumento automático capaz de distinguir com precisão entre ambos, usando a contagem de referência de eritrócitos para o cálculo do número de plaquetas. Em outro método, as plaquetas são contadas em um citômetro de fluxo, após marcação com anticorpo monoclonal fluorescente, como CD41, CD42 ou CD61. Se houver defeito genético nas plaquetas, com falta de uma das glicoproteínas da membrana, um anticorpo monoclonal pode não se ligar, por isso se usa uma mistura de anticorpos anti-CD41 e anti-CD61. Uma técnica similar à esta tem sido recomendada para contagens de plaquetas de rotina em pacientes severamente trombocitopênicos quando uma contagem for decisiva quanto à indicação, ou não, de transfusão de plaquetas.
Contagem Diferencial de Leucócitos ou Fórmula Leucocitária
É a especificação das categorias de leucócitos, expressa em percentagem ou contagem absoluta, esta preconizada pela ICSH. A grande maioria das contagens diferenciais é feita em equipamento automático, por citometria de fluxo, como parte do hemograma, com a diferenciação em categorias sendo baseada em características físicas e/ou bioquímicas das células. Os instrumentos automatizados oferecem alta sensibilidade e precisão na quantificação das células sanguíneas, bem como na contagem diferencial de leucócitos. No entanto, algumas amostras analisadas pelos contadores automatizados de células ainda requerem avaliação através da distensão de sangue periférico para permitir a observação de anormalidades morfológicas e outras alterações. Sendo assim, na maioria dos laboratórios que usam contadores que fornecem fórmula leucocitária com identificação de cinco a nove tipos celulares, o exame ao microscópio só é realizado em casos selecionados. É feita uma distensão preparada manualmente ou em máquina automática e a contagem diferencial é feita por um observador ao microscópio (fórmula leucocitária manual). Os critérios para a confecção e avaliação das distensões de sangue periférico são: (1) idade menor de 8 anos, devido à dificuldade de definir valores de referência nesse grupo etário; (2) procedência dos pacientes: todos os pacientes internados ou do setor de emergência dos hospitais atendidos pelos laboratórios; (3) solicitações médicas específicas (pesquisa de linfócitos atípicos, esferócitos e outros); (4) limites dos parâmetros numéricos mínimos e máximos e (5) alarmes emitidos pelos aparelhos. Os principais alarmes (Flags) compreendem: Imm Gran (granulócitos imaturos), Bands (bastões), Blasts (blastos), Variant-Lymphs (linfócitos atípicos), NRBC (eritroblastos), Ptl.Clumps (agregados plaquetários), Review slide (revisar lâmina), Abn. Lymphs/ aged (linfócitos anormais/envelhecidos) e Flafgs (incerteza no resultado).
O arbítrio de critérios muito amplos, limitando a porcentagem de casos a examinar, facilita o trabalho, mas amplia o número de dados perdidos. Apesar de a tecnologia eletrônica propiciar resultados confiáveis e análises de alta qualidade, tais aparelhos não são capazes de identificar muitas alterações hematológicas, que podem ser clinicamente significativas ou biologicamente relevantes. A tabela 1 apresenta as alterações hematológicas que não são identificadas pelos contadores eletrônicos. Por outro lado, critérios muito restritos contribuem de modo insuficiente para viabilizar um setor de hematologia sobrecarregado financeiramente pelo alto custo da tecnologia importada.
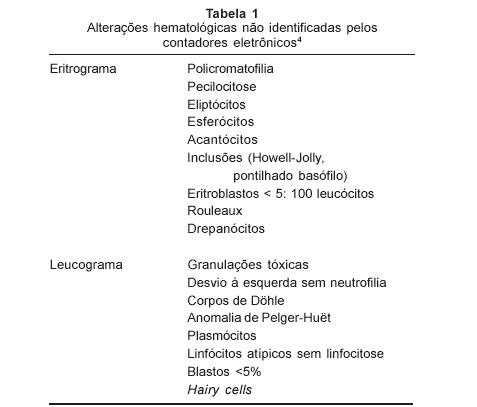
Failace, R; Pranke, P., 2004.
Os leucócitos normalmente presentes no sangue periférico podem ser classificados em cinco ou seis categorias, conforme forem separados ou não os neutrófilos segmentados dos não-segmentados ou bastonados. A fórmula leucocitária também inclui as células anormais presentes. Os eritroblastos podem ser incluídos como uma das categorias da fórmula ou anotados fora desta, com seu número relativo a 100 leucócitos. No primeiro caso, a contagem não corrigida é chamada de contagem total de células nucleadas (CTCN) e é usada para o cálculo dos valores absolutos de cada tipo celular. No segundo caso, a contagem total, subtraída do número de eritroblastos, converte-se em contagem de leucócitos. As contagens diferenciais ao microscópio são satisfatoriamente exatas, mas pouco reprodutíveis, ao passo que as contagens automatizadas são muito reprodutíveis, mas, algumas vezes, inexatas.
Na contagem diferencial ao microscópio, a inexatidão decorre tanto da má distribuição das células quanto de erros de identificação. Os diferentes tipos de leucócitos não se distribuem uniformemente sobre a lâmina. A extremidade da distensão contém mais neutrófilos do que linfócitos, enquanto os monócitos são distribuídos uniformemente em todo o comprimento. Quando há grandes células imaturas (blastos, promielócitos e mielócitos), elas se acumulam mais nos bordos da distensão do que na parte central e mais distalmente em relação aos linfócitos, basófilos, neutrófilos e metamielócitos. Essa má distribuição agrava-se quando a distensão é fina demais ou quando se utilizar uma distensora de bordo irregular. O rastreamento em ameia modificado é um dos métodos indicados para tentativa de superar os erros devido à má distribuição, no qual são contados dois campos perto e paralelos à borda da distensão, depois quatro campos em ângulo reto e dois campos paralelos ao bordo, e assim por diante. Na prática, a falta de reprodutibilidade da contagem ao microscópio é tão grande que um pequeno grau de inexatidão, provocado pela má distribuição das células, não tem maiores consequências. Se ocorrer agregação de leucócitos, a má distribuição será tão grande que impossibilitará uma contagem diferencial exata.
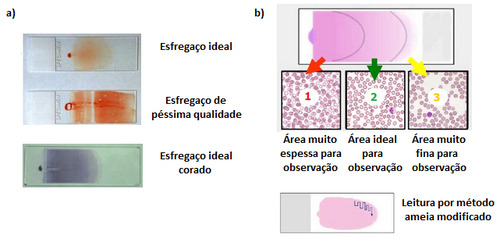
Figura 1. Distensão de sangue periférico: (a) diferença entre um esfregaço ideal e um esfregaço de péssima qualidade; (b) área ideal de leitura e modo de percorrer as distensões de sangue para a contagem diferencial de leucócitos pelo método ameia modificado. Modificado de http://www.ebah.com.br/content/ABAAAA7rAAH/daty-tecnica-coloracao-lamina-sangue-esfregaco, acesso em 08/01/2015.
A inexatidão decorrente de erros na identificação das células, em geral, não é grande quando as contagens diferenciais são feitas por técnicos experientes, em distensões sanguíneas de boa qualidade, exceto para a diferenciação dos neutrófilos em segmentados e bastonados. Também é difícil distinguir um monócito de um grande linfócito ou um basófilo degranulado de um neutrófilo. Ainda, neutrófilos em degeneração podem ser classificados incorretamente como eritroblastos e a desintegração preferencial dos neutrófilos pode provocar elevação espúria de linfócitos. Células destruídas cuja natureza ainda possa ser determinada devem ser contadas com a categoria na qual pertencem. Células de natureza impossível de identificar devem ser contadas como uma categoria separada, ou a percentagem e o número absoluto das células de todas as demais categorias serão falsamente aumentados.
A reprodutibilidade, ou a falta dela, expressa-se pelo desvio padrão (DP) ou pelo coeficiente de variação (CV) de uma série de determinações feitas na mesma amostra. O pequeno número de células contado ao microscópio na fórmula leucocitária causa baixa reprodutibilidade dos resultados. A falta de reprodutibilidade é maior nas células em menor número, particularmente nos basófilos. Se for importante para o diagnóstico saber se há basofilia, é necessário aumentar a precisão, fazendo-se uma contagem absoluta de basófilos no hemocitômetro, técnica em desuso, ou contando mais do que as habituais 100 células. A pouca precisão da contagem de células em pouco número significa que os limites de referência inferiores das contagens de basófilos e de eosinófilos incluem o zero e é, portanto, impossível dizer se um paciente tem basopenia ou eosinopenia. Deve-se reconhecer, ainda, que a reprodutibilidade da contagem de neutrófilos bastonados é tão baixa que, em geral, é inútil conta-los separadamente dos segmentados; basta um comentário “desvio à esquerda” ou “aumento dos bastonados”, quando se notar um aumento óbvio.
Não há um método de referência aceito internacionalmente para a contagem diferencial ao microscópio, mas o CLSI (Manual Clinical and Laboratory Standards Institute) estabeleceu um método próprio. Usa-se uma distensão manual, corada com coloração Romanowsky; e dois técnicos experientes contam, cada um, 200 células, correndo a lâmina “em ameia”, sendo o resultado a média da contagem diferencial dessas 400 células.
6. Contagem de Reticulócitos
São eritrócitos jovens, recém-liberados pela medula óssea e que ainda contém RNA ribossômico. Pela exposição de células não fixadas a certos corantes, como o azul-brilhante-de-cresil ou o novo-azul-de-etileno, os ribossomos são precipitados e corados, aparecendo com um retículo. Como as células ainda estavam vivas quando expostas ao corante, a coloração é chamada de supravital. Com o novo-azul-de-metileno, os eritrócitos coram-se em azul-esverdeado-claro, aparecendo o retículo em púrpura-azulado. O CLSI classifica como reticulócito “qualquer eritrócito não-nucleado contendo duas ou mais partículas de material corado em azul, correspondendo a RNA ribossômico”.
O RNA responsável pela formação do retículo à coloração supravital, nas distensões coradas pelo Romanowsky, provoca uma basofilia citoplasmática difusa que, em combinação com a acidofilia da hemoglobina, produz características de coloração conhecidas por policromatocitose ou policromasia. Células que contêm corpos de Pappenheirmer podem ser difíceis de distinguir dos reticulócitos tardios, com apenas poucos grânulos de material retículo-filamentoso, podendo-se contracorar uma preparação de reticulócitos com a coloração de Perls para identificar os corpos de Pappenheirmer, ou com colorações Romanowsky, para identificar corpos de Howell-Jolly.
Contam-se os reticulócitos como percentagem dos eritrócitos. O uso na ocular do microscópio de um micrômetro ocular, o gratículo de Miller, facilita e torna mais precisa a contagem. Os reticulócitos são contados, em cada campo, no quadrado grande, e o total de eritrócitos no quadrado pequeno, que tem um nono do tamanho do grande. Devem ser contados campos consecutivos e não campos ao acaso e contados os eritrócitos que tocam dois lados escolhidos do quadrado, e não contados os que tocam os outros dois lados. O número de células que deve ser contado, para se obter um grau aceitável de reprodutibilidade, é maior quanto menor for a percentagem de reticulócitos. Contando-se 20 campos, são contados os reticulócitos entre cerca de 2 mil eritrócitos, sendo:
% Reticulócitos = Reticulócitos em 20 quadrados grandes x 100
Eritrócitos em 20 quadrados pequenos x 9
As contagens de reticulócitos têm sido tradicionalmente expressas em percentagem. Dispondo-se da contagem dos eritrócitos, pode-se calcular o número absoluto de reticulócitos. Enquanto a percentagem de reticulócitos tem a vantagem de fornecer uma indicação da sobrevida periférica dos eritrócitos, o número absoluto de reticulócitos exprime com maior exatidão a produção de eritrócitos da medula óssea. A contagem de reticulócitos é estável com conservação do sangue anticoagulado com EDTA por até 24h à temperatura ambiente e por vários dias a 4ºC.
O método de referência para a contagem de reticulócitos do CLSI baseia-se em técnica com coloração por novo-azul-de-metileno.
Referências
Bain, B., J. Células Sanguíneas: um guia prático. Tradução de Renato Failace.4 ed. Porto Alegre: Artmed, 2007. 487 p.
Failace, R.; Pranke,P. Avaliação dos critérios de liberação direta dos resultados de hemogramas através de contadores eletrônicos. Rev. Bras. Hematol. Hemoter. vol.26 no.3 São José do Rio Preto, 2004. Disponível em http://dx.doi.org/10.1590/S1516-84842004000300004, acesso em 08/01/2015
2 notes
·
View notes
Text
Marcadores Tumorais
Marcador tumoral é macromolécula que, independentemente da função (enzimática, hormonal ou não-funcional), é produzida por células neoplásicas e secretada nos fluidos biológicos (sangue, líquidos cavitários e de excreção) e pode ser detectada e mensurada nesses fluidos por exames não invasivos realizados in vitro. Em razão da importância dos resultados, os imunoensaios usados no estudo de marcadores tumorais devem ter elevada sensibilidade e especificidade. A sensibilidade pode ser incrementada pelo uso de testes imunoenzimáticos com reveladores do tipo luminescência, fluorescência ou radioatividade que aumentam a intensidade do sinal de detecção do imunocomplexo, enquanto a elevada especificidade pode ser garantida pela utilização de anticorpos monoclonais para a captura e a revelação. Outra característica importante é que o ensaio seja quantitativo pois, como veremos a seguir, a determinação de um marcador tumoral geralmente não serve para diagnóstico mas, uma vez estabelecida e confirmada sua associação com a neoplasia presente, essa determinação servirá para acompanhamento do caso ao longo do tempo. A investigação laboratorial dos marcadores tumorais tem algumas aplicações rotineiras na clínica médica, como: (a) triagem e diagnóstico, (b) prognóstico; (c) monitorizar sucesso terapêutico e (d) seguimento (follow-up).
Embora válido para a maioria dos pacientes, o padrão dos principais marcadores pode não refletir a situação de cada um dos pacientes ou de todos eles. Por isso, geralmente está indicada a investigação não apenas do marcador mais associado àquele tipo de tumor, mas vários, de modo que, se confirmado(s) como associado(s) ao tumor, possam servir para o acompanhamento.
Principais Marcadores Tumorais
1. Alfa-Fetoproteína (AFP)
É uma glicoproteína com homologia parcial à albumina, mas esta não contém açúcares. Na vida intra-uterina, AFP é sintetizada no fígado fetal e no saco vitelino, elevando-se rápido entre a 12ª e a 14ª semanas de gestação e caindo ao nascimento, quando passa a ser sintetizada pelo fígado e pelo trato gastrointestinal. Pelo 8º mês de vida, os níveis de AFP já são similares aos níveis de adultos sadios, mantendo-se baixos.
AFP sérico < 0,25 ng/dL
Aplicações na determinação de AFP:
a) Defeitos do tubo neural: malformações como espinha bífida e anencefalia.
Aumento de AFP no soro de gestante entre 15ª e 20ª semanas de gestação: gestação múltipla, idade gestacional subestimada, morte fetal, tumores.
Aumento de AFP e de acetilcolinesterase no líquido amniótico: defeitos de tubo neural.
b) Síndrome de Down (SD)
Diminuição de AFP e de estriol e aumento de hCG em sangue materno e fetal no 2º trimestre gestacional. Os valores desses marcadores na SD se sobrepõem muito aos valores encontrados em gestações normais, o que reduz a triagem clínica da SD.
c) Marcador Tumoral
Aumento de AFP está mais especificamente associado aos tumores hepáticos, mas também pode estar presente em doenças hepáticas, como hepatites crônicas, e cirroses. AFP foi chamada de antígeno oncofetal pois, além de estar associada ao câncer hepático, está presente em altas concentrações no feto.
Aumento de AFP indica pior prognóstico dos tumores testiculares, nos quais o b-hCG é o marcador tumoral mais específico.
2. Gonadotrofina Coriônica Humana (hCG)
Os hormônios glicoproteicos são constituídos de uma cadeia alfa, comum a todos os membros desses hormônios, e de uma cadeia b, específica de cada um deles: hCG, hormônio luteinizante (LH), hormônio folículo-estimulante (FSH) e tireotropina ou hormônio tireoestimulante (TSH).
beta-hCG partilha homologia com a cadeia beta-LH, sendo necessário a utilização de anticorpos monoclonais (específicos) para a quantificação de hCG em amostras de soro, mas não em amostra de urina, para teste de gravidez, onde só o beta-hCG está presente.
Aplicações na determinação de hCG:
a) Detectar gravidez
Detecção qualitativa ou quantitativa de hCG a partir da 1ª semana pós-implantação, ou seja, por volta do período esperado para a menstruação. Alguns testes ultrassensíveis podem detectar no 2º ou 3º dia após a implantação. Como a meia-vida de hCG é variada, pode ser detectada por até algumas semanas após a interrupção da gravidez.
b) Acompanhar gravidez
Determinação quantitativa de hCG consecutiva em intervalos de 2 a 4 dias pode ajudar a acompanhar riscos de morte fetal.
Diminuição de hCG pode estar associada com morte fetal ou com insuficiência placentária.
Aumento de hCG pode estar associada a gravidez ectópica, a síndrome de Down e a pré-eclâmpsia.
c) Marcador Tumoral
Aumento de hCG está associada a tumores de células germinativas e a carcinomas de testículos, além de alguns tumores de mama, de pulmão e de intestino. A determinação é solicitada na vigência de sinais clínicos ou em grupos com fatores de risco, e não como triagem.
3. Antígeno Carcinoembriônico (CEA)
Assim como AFP, está presente em elevadas concentrações na vida fetal. Tem sido o marcador tumoral mais solicitado, em número próximo ao PSA. Representa um conjunto de proteínas não-mucinosas na superfície celular com variações antigênicas. O esqueleto proteico é altamente conservado, alvo dos anticorpos utilizados nos testes. O CEA também é secretado por células epiteliais do trato gastrointestinal e eliminado nas fezes, e apenas parte aparece no sangue.
Aplicações na determinação de CEA:
a) Marcador Tumoral
É útil quando associado aos aspectos clínicos e a outros marcadores tumorais.
Aumento de CEA está associado ao câncer colorretal não mucinoso mas, embora seja o principal marcador, detecta apenas parte dos casos.
Aumento também pode estar associado a alguns casos de câncer de pulmão, de mama, de estômago, de ovário, de pâncreas e outros. Curiosamente, CEA pode aparecer aumentado apenas na etapa de disseminação (metástase) desses tumores.
Resultados ligeiramente elevados podem aparecer em processos benignos inflamatórios do pulmão e do trato digestivo.
4. Antígeno Prostático Específico (PSA)
PSA é uma glicoproteína virtualmente produzida exclusivamente pela próstata. Indivíduos sadios têm PSA em baixas concentrações e em duas formas: livre e complexada com proteínas inibidoras de proteases (alfa-2-macroglobulinemia, alfa-1-antiquimiotripsina e alfa-1-inibidor de protease). Na forma complexada, alguns epítopos estão inacessíveis, bloqueados por estas proteínas. Assim, a escolha adequada de anticorpos monoclonais permite a determinação da concentração de PSA total (livre + complexado) e da fração livre.
Aplicações na determinação de PSA:
a) Marcador Tumoral
Aumento de PSA (>10 ng/dL) junto ao exame de toque retal e sinais clínicos indicam a biópsia para confirmar o diagnóstico de câncer de próstata. Logo, serve como triagem, fazendo parte da rotina anual de homens a partir dos 50 anos. Os valores também mostram correlação com a extensão do tumor, sendo um marcador considerado no prognóstico. Dada sua especificidade, também é utilizado para acompanhar a evolução do caso e as recidivas posteriores ao tratamento inicial, por testes ultrassensíveis (<0,1 ng/dL), que detectam precocemente recidivas e metástases pós-cirúrgicas e pós terapêuticas. Aumento pode ser encontrado também em ciclistas e em equitadores.
PSA é antigenicamente diferente da fosfatase ácida prostática (PAP). A determinação de PAP utiliza anticorpos que não interagem com outras fosfatases ácidas, mostrando maior especificidade para o câncer de próstata. A determinação conjunta de PSA e PAP, aliada ao exame clínico, é utilizada para aumentar o valor preditivo e a sensibilidade do diagnóstico precoce de câncer de próstata.
Resultados ligeiramente elevados (até 10 ng/dL) podem ser decorrentes de prostatites benignas e hiperplasia crônica benigna prostática.
Aumento transitório: após o exame de toque retal.
Análise de PSA livre é realizada nos casos benignos, que devem resultar acima de 25% do total para excluir malignidade. A determinação da proporção PSA livre/ PSA total não tem significado para valores de PSA > 10ng/dL, que devem ser investigados.
5. Cancer Antigen 125 (CA 125)
Principal marcador de carcinomas serosos ovarianos, que frequentemente invadem a cavidade peritoneal, com a formação de ascites.
Aplicações na determinação de CA 125:
a) Marcador Tumoral
Aumento de CA 125 está associado com carcinomas serosos ovarianos. A determinação pré-operatória e pré-quimioterapia é útil para acompanhar o sucesso da intervenção e posterior recorrência.
Aumento também pode estar associado a casos de câncer de pulmão, de mama e de endométrio. A falta de especificidade o torna pouco útil na triagem e no diagnóstico de câncer de ovário, mas é o mais associado a esse câncer, sendo empregado no acompanhamento do caso ao qual se aplique.
Aumento também pode estar associado a condições benignas como cirrose, endometriose grave, cistos ovarianos, pericardites, ascites, derrames pleurais e primeiro trimestre gestacional.
6. Cancer Antigen 19-9 (CA 19-9)
CA 19-9 é uma glicoproteína mucinosa descrita inicialmente na superfície de células de carcinoma colorretal. Tem conteúdo de carboidrato elevado, mostrando estrutura semelhante ao antígeno de Lewis, exigindo cuidado na conservação da amostra por sua composição ser muito sensível a neuraminidases bacterianas. Os anticorpos anti-carboidratos se complexam em parte da molécula, de modo que a diluição da amostra reduz os efeitos interferentes, tornando os resultados mais confiáveis.
Aplicações na determinação de CA 19-9:
a) Marcador Tumoral
Aumento de CA 19-9 está associado a tumores gastrointestinais, como de pâncreas, de vesícula biliar, de estômago e colorretal. Embora seja altamente específico, a sensibilidade é maior apenas nos estágios mais tardios, inviabilizando o seu uso na triagem.
Resultados ligeiramente elevados podem ser decorrentes de cirroses e outras hepatopatias, pancreatites ou fibrose cística.
7. Cancer Antigen 15-3 (CA 15-3)
CA 15-3 é uma mucina reconhecida por anticorpos monoclonais que também reconhecem moléculas de leite humano, sendo o principal marcador para o câncer de mama. É bastante sensível a proteases e neuraminidases, exigindo cuidado no armazenamento das amostras para evitar contaminação bacteriana.
Aplicações na determinação de CA 19-9:
a) Marcador Tumoral
Aumento de CA 15-3 está associado ao câncer de mama, mas tem baixa sensibilidade, podendo estar presente só na metástase. Assim, é sempre solicitado no acompanhamento do câncer de mama, mesmo quando não se mostra como um marcador inicial no tumor primário. Embora a associação de CA 15-3 e CEA aumente a sensibilidade do estudo do câncer de mama, o CEA apresenta desvantagens de especificidade, o que acaba por invalidar a associação dos marcadores.
Aumento também pode estar associado a doenças benignas hepáticas, pulmonares, ovarianas e mamárias.
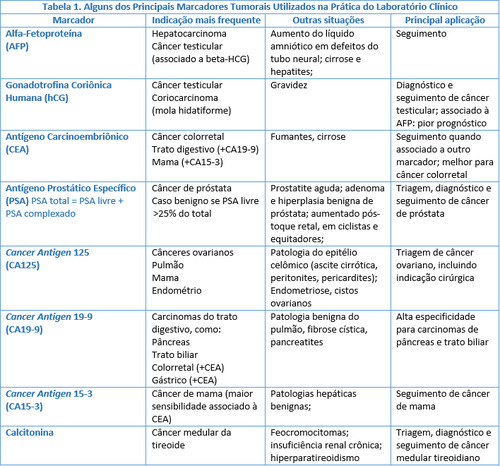
Adaptado de Vaz, A.J. et al, 2012.
Referência
VAZ, A. J.; TAKEI, K; BUENO, E. C. Imunoensaios: fundamentos e aplicações. Rio de Janeiro: Guanabara Koogan, 2012. 372 p
3 notes
·
View notes
Text
Hepatites Virais
1. Hepatite A
Agente causador: vírus HAV, pertencente à família Picornaviridae.
Características do agente: partícula viral não envelopada, composta por proteínas do capsídeo e por genoma de RNA fita simples linear.
Transmissão: oro-fecal (enteral) por água e alimentos contaminados por fezes de indivíduos infectados. Após a ingestão de HAV, ele é conduzido através do epitélio intestinal até chegar ao fígado, ocorrendo a replicação viral no citoplasma dos hepatócitos. Do fígado, HAV é transportado através dos ductos biliares para o intestino e, por ser resistente à inativação pelas enzimas proteolíticas, biliares e intestinais, alcança as fezes. O vírus é resistente, ainda, ao pH ácido para sobreviver no trato gastrointestinal, de modo que o tratamento das verduras com ácido acético (vinagre) não elimina o vírus. A transmissão sanguínea é rara; o doador de sangue deve estar na fase virêmica prodrômica.
Período de incubação: 15 a 45 dias. O vírus é excretado nas fezes no final da incubação e na primeira semana de doença, mantendo-se viável nas fezes por cerca de 30 dias.
Sintomas: as crianças desenvolvem a doença no tipo subclínico (branda), sendo os principais reservatórios do agente. Em outras faixas etárias, a doença é sintomática (grave e prolongada em adultos). Os sintomas são indistinguíveis dos outros tipos de hepatite, exceto pela diarreia na fase aguda, que ocorre em 60% das crianças e em 20% dos adultos.
Complicações: não há cronicidade nem risco aumentado para carcinoma hepatocelular.
Diagnóstico: a presença de HAV no organismo induz resposta imune humoral e celular. A principal forma de diagnóstico é a análise da resposta humoral, através da detecção de anticorpos específicos contra antígenos das proteínas estruturais do capsídeo viral no soro do paciente:
a. anti-HAV IgM: sua presença no soro indica infecção aguda, podendo ser detectado do início até 4 meses após a infecção. Esse exame deve ser solicitado em todos os casos de suspeita clínica de hepatite aguda, juntamente com o HBsAg e anti-HBc IgM (indicativos de hepatite B).
b. anti-HAV IgG: sua presença no soro indica infecção corrente ou passada, podendo ser detectado, respectivamente, logo após o surgimento de anti-HAV IgM, no início da infecção, ou na ausência de anti-HAV IgM, após a imunização por contato antigo com HAV ou por vacinação contra hepatite A, com vírus inativado, garantindo a imunidade duradoura. Esse exame não deve ser solicitado isoladamente para diagnóstico de hepatite aguda ou crônica, nem para testagem pós-vacinal, já que os níveis de anticorpos pós-vacinais podem estar baixos, não significando ausência de proteção. Seu maior valor está em inquéritos epidemiológicos. * Os Kits comerciais disponíveis detectam anti-HAV total, de forma que a presença de anti-HAV na ausência de anti-HAV IgM indica o resultado positivo para anti-HAV IgG.

Prevenção: depende de cuidados gerias de higiene e de imunoprofilaxias passiva (injeção intramuscular de gamaglobulina A, antes da exposição, que evita 85 a 95% dos casos, ou até 2 semanas após a infecção para prevenir ou atenuar a infecção) e/ou ativa (vacina com vírus inativado).
2. Hepatite B
Agente causador: vírus HBV, pertencente à família Hepadnaviridae.
Características do agente: a partícula viral completa (partícula de Dane) é o tipo infectante encontrado no plasma, composto por capsídeo viral envelopado, onde ancoram-se três diferentes tipos de proteínas de superfície (principal é a HBsAg), e por genoma de DNA circular fita dupla, que replica-se por um RNA intermediário.
Transmissão: via sanguínea (parenteral) por relações sexuais, transmissão vertical, contato pessoa-pessoa através de cortes e feridas abertas. Após a exposição das pessoas suscetíveis ao vírus, ele é conduzido via sanguínea ao fígado, ocorrendo a replicação viral no citoplasma dos hepatócitos, onde o RNA pré-genômico se associa ao HBsAg e à polimerase do HBV para formar o nucleocapsídeo. O RNA pré-genômico é encapsulado e transcrito reversamente em DNA genômico. O HBV, após se ligar ao hepatócito e penetrar as células, perde seu envoltório e o seu DNA genômico entra no núcleo, sendo convertido em cccDNA (DNA circular covalentemente fechado), forma replicativa do DNA HBV. Durante a infecção, cccDNA acumula-se no núcleo, sendo o molde transcricional com papel na persistência viral, tanto na reativação da replicação após o término da terapia anti-viral como na falha terapêutica. Nucleocapsídeos recém-formados podem voltar para o núcleo para amplificar e manter o pool de cccDNA ou ser envelopados e secretados para o sangue, onde irão infectar outros hepatócitos.
Período de incubação: 30 a 180 dias, caracterizada pela presença de HBsAg e ausência de sintomas clínicos. HBV pode sobreviver pelo menos 7 dias fora do organismo humano, podendo causar infecção se entrar em contato com alguém não infectado.
Complicações: pode resultar em doença aguda e crônica do fígado, com risco aumentado para o surgimento de carcinoma hepatocelular. Membros dessa família de vírus não são citotóxicos; as infecções são resultantes da defesa do hospedeiro, com a morte das células que expressam as proteínas do HBV.
Diagnóstico: a presença de HBV no organismo induz resposta imune humoral e celular. O diagnóstico é baseado na presença de antígenos virais e de anticorpos específicos contra o vírus.
a) HBsAg (ou antígeno Austrália): é uma proteína de superfície do HBV. Sua presença no soro indica que o paciente está infectado. É o primeiro marcador a positivar na infecção aguda, podendo ser detectado a partir de três semanas após exposição ao vírus, precedendo geralmente os sintomas da doença aguda e a elevação das transaminases. Na infecção auto-limitada, de bom prognóstico, que ocorre em aproximadamente 95% dos adultos, o HBsAg persiste na circulação por um a quatro meses. Seu desaparecimento ocorre juntamente com o surgimento do seu anticorpo, o anti-HBs, refletindo cura da infecção, garantindo imunidade. A persistência de HBsAg após seis meses da provável exposição ou quatro meses após a fase aguda indica evolução para hepatite crônica. Esse exame deve ser solicitado na suspeita clínica de hepatite B aguda ou crônica.
b) Anti-HBc IgM: anticorpo anti-antígeno do nucleocapsídeo (core) viral da classe IgM é o primeiro anticorpo detectável após infecção pelo HBV. Sua presença no soro indica infecção aguda, podendo ser detectado a partir do início dos sintomas. São predominantes nos primeiros quatro meses de infecção, a partir de quando o anti-HBc IgG passa a sobressair. Em infecções auto-limitadas, o anti-HBc IgM desaparece em poucos meses. Esse exame deve ser solicitado em todos os casos de suspeita clínica de hepatite aguda, juntamente com o HBsAg para diagnóstico de hepatite B aguda, e anti-HAV IgM para diagnóstico de hepatite A aguda.
c) Anti-HBc IgG: anticorpo anti-antígeno do nucleocapsídeo (core) viral da classe IgG. Sua presença no soro indica contato com o vírus HBV, independentemente da evolução: cura, portador ou hepatite crônica, podendo ser detectado desde o início dos sintomas de hepatite B aguda, persistindo por toda a vida. Não confere proteção e não está presente em pacientes vacinados que nunca foram infectados anteriormente. Esse exame não deve ser solicitado para o diagnóstico de hepatite B aguda ou crônica. Seu valor está na triagem de doadores de sangue e inquéritos epidemiológicos. * Os Kits comerciais disponíveis detectam anti-HBc total, de forma que a presença de anti-HBc na ausência de anti-HBc IgM indica o resultado positivo para anti-HBc IgG.
d) Anti-HBs: é o último anticorpo detectável na hepatite aguda. Sua presença no soro indica a resolução do processo infeccioso, por ser o principal anticorpo neutralizante do HBV, ou resposta à vacina contra hepatite B, com HBsAg recombinantes, conferindo imunidade duradoura. Em infecções auto-limitadas, o anti-HBs surge de quatro a seis meses do contágio, logo após queda nos níveis de HBsAg. Esse exame não deve ser solicitado para o diagnóstico de hepatite B aguda ou crônica. Seu valor está na constatação da cura da infecção aguda ou na testagem pós-vacinal.
e) HBeAg: é uma proteína secretada por antígenos do nucleocapsídeo (core) viral após a tradução do vírus. Sua presença no soro indica replicação viral, correlacionando-se bem com a viremia. Em infecções auto-limitadas, surge em média uma semana após HBsAg e desaparece após duas a seis semanas, quando seu anticorpo, o anti-HBe, torna-se detectável. Sua persistência após dez semanas sugere evolução para a forma crônica. Pacientes sem atividade viral permanecerão como portadores assintomáticos do vírus (HBeAg- e anti-HBe+) enquanto aqueles com multiplicação viral persistente desenvolverão hepatite B crônica (HBeAg+ e anti-HBe-).
f) Anti-HBe: anticorpo relacionado à boa evolução. Sua presença é indicativa de resolução da hepatite aguda ou caracteriza o paciente com infecção crônica como portador “inativo” (HBeAg- e anti-HBe+), indicando inatividade do vírus e baixa infecciosidade. Em infecções auto-limitadas, surge após o desaparecimento de HBeAg, associada à queda dos níveis de HBsAg, podendo persistir detectável por anos. O sistema “E” (HBeAg e anti-HBe) não é utilizado rotineiramente na avaliação de hepatite B aguda. Seu maior valor está na caracterização da hepatite crônica. A pesquisa do HBeAg só se justifica se o HBsAg for positivo.
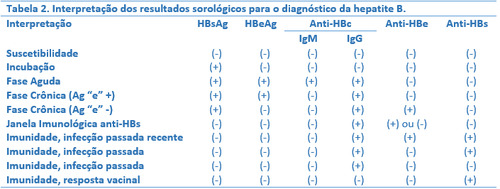
Adaptado de Ferreira, A.W., et al., 2013.
Janela Imunológica: a infecção aguda pelo HBV tem duas janelas imunológicas: quando ainda não se detecta nenhum marcador imunológico, apenas o DNA viral, antes do HBsAg e quando o HBsAg já não é mais detectado, mas ainda não houve o surgimento de anti-HBs, apenas estando presente o anti-HBc IgM.
Prevenção: profilaxias passiva e ativa, pós exposição ao HBV, usando HBIG e vacina ou somente a vacina para o vírus B, são altamente eficazes.
Esquema vacinal:
Indivíduos imunocompetentes: 3 doses, com intervalo de 1 mês entre a primeira e a segunda e 6 meses entre a primeira e a terceira dose (0,1 e 6 meses).
Perinatal: primeira dose logo após o nascimento (de preferência, dentro de 24h).
Prematuros: dose extra com 2 meses de idade (0,1,2 e 6 meses).
Tratamento:
Influenciam a prescrição do tratamento: (1) estágio da doença; (2) detecção ou não de HBeAg; (3) resistência ao medicamento (principalmente nos estágios finais da doença crônica do fígado); (4) persistência do cccDNA. O tratamento tem como objetivo alcançar a resposta sustentada, ou seja, a supressão da replicação do HBV e a remissão da doença hepática e, para isso, precisa-se: (1) soroconversão do HBeAg para o anti-HBe; (2) diminuição dos níveis do DNA HBV; (3) soroconversão do HBsAg para o anti-HBs. Deve ser dado a todos os pacientes com carga viral elevada (>2000UI/mL), que apresentem alanina aminotransferase (ALT ou TGP) elevada e alterações na biópsia hepática. Os casos com cirrose hepática devem ser tratados sempre que o DNA viral for detectado no soro.
Medicamentos:
A primeira opção é o Interferon a (INF-a), que é contraindicado para pacientes com doença hepática descompensada, sendo aconselhável sua substituição pelos análagos de núcleos(t)ídeos (AN), como a lamivudina, o adenofovir dipivoxla, o entecavir e o tenofovir.
3. Hepatite C
Agente causador: vírus HCV, pertencente à família Flaviviridae.
Características do agente: a partícula viral é composta por capsídeo viral envelopado e por genoma de RNA linear fita simples. Quase espécie: população complexa que consegue evadir a resposta imune, resultando na persistência do vírus. A composição da quase espécie do HCV refere-se à variabilidade genética dentro do indivíduo infectado, resultado de nova infecção com população viral heterogênea, e ao acúmulo de mutações genéticas durante o curso da infecção.
Transmissão: mais eficientemente pela exposição percutânea direta com sangue infectado, por várias vias como parenteral, que é a principal; transfusão de sangue e transplante, que diminuiu muito após os testes anti-HCV; sexual e vertical, ambas de baixo risco, mas facilitadas pela coinfecção por HIV.
Período de incubação: 15 a 150 dias
Sintomas: 1/3 dos adultos desenvolvem sintomas clínicos e icterícia cerca de 3 a 12 semanas após a infecção. A infecção aguda é auto-limitada; os sintomas permanecem por semanas e desaparecem com a redução dos níveis de alaninaaminotranferase (ALT ou TGP).
Complicações: pode resultar em doença crônica do fígado (75 a 85%), com risco aumentado para o surgimento de cirrose e de carcinoma hepatocelular.
Diagnóstico: é geralmente casual, já que a maioria dos indivíduos apresenta a forma crônica e assintomática.
a) HCV-RNA: é o exame que confirma a infecção em atividade, estando presente tanto na fase aguda como na crônica. Esse exame deve ser feito por teste de biologia molecular e pode ser detectado no sangue cerca de 15 dias após a infecção. A infecção crônica é caracterizada pela persistência do RNA do HCV por mais de 6 meses em altos níveis. O aparecimento das quase espécies são determinantes para a cronicidade, pois resultam na persistência do vírus. *Diagnóstico molecular: detecção e quantificação do RNA do HCV por PCR qualitativo e quantitativo permitem a determinação da viremia precocemente (ainda na janela imunológica) e o acompanhamento da terapêutica pela quantificação da carga viral, respectivamente. Essas técnicas têm sido as mais adequadas para a caracterização do estado de infecção do HCV.
b) HCV: o próprio vírus da hepatite C é um marcador específico altamente utilizado na clínica. Ainda, pode-se aliar resultados bioquímicos de função hepática, como os níveis séricos das enzimas TGO e TGP. O critério diagnóstico consiste no resultado do aparelho Cobas e-Analyzer e, se necessário, na verificação dos níveis séricos das enzimas de função hepática.
c) anti-HCV: é um anticorpo anti-antígenos do HCV. Sua presença no soro indica exposição ao HCV, não sendo capaz de diferenciar as fases da doença, pois persistem na circulação na grande maioria dos pacientes, independentemente da evolução: cura (com eliminação do vírus) ou hepatite crônica. São detectáveis somente a partir de 5 a 10 semanas (média de 50 dias) após a contaminação e, por surgirem tardiamente, sua pesquisa precoce pode levar a resultado falso-negativo. Na prática, esse exame não deve ser solicitado nos casos de suspeita clínica de hepatite aguda, sendo indicado no diagnóstico diferencial das hepatites crônicas. Nos casos de forte suspeita de infecção aguda pelo HCV (quando foram excluídas hepatites A e B), o anti-HCV pode ser solicitado para documentar eventual soroconversão.

*São considerados casos de hepatite C crônica aqueles em que o indivíduo apresentou mudança documentada do perfil sorológica (soroconversão), ou seja, anti-HCV não reagente na primeira testagem e anti-HCV reagente na segunda, realizada após 90 dias.
Janela Imunológica: durante a fase aguda da infecção (6 primeiros meses após a infecção), somente 50 a 70% dos pacientes são detectados por meio de anticorpos contra o HCV, pelas técnicas imunoenzimáticas, chegando a 90% em 3 meses. Portanto, durante essa janela imunológica ou período pré-soroconversão, um resultado sorológico negativo não exclui a possibilidade de infecção pelo HCV.
Prevenção: não há vacina contra esse vírus. Obstáculos: (1) falta de sistema de cultura adequado para a propagação do vírus; (2) falta de um modelo animal de pequeno porte; (3) alta heterogeneidade do vírus (necessidade do desenvolvimento de uma vacina para cada genótipo); (4) resposta de anticorpos aos antígenos recombinantes baixa em humanos; (5) imunidade do HCV não completa (após a recuperação da infecção, é possível a reinfecção com exposição a cepas iguais ou diferentes. Por isso, o controle deve ser feito por medidas de saúde pública e disponibilidade de tratamento.
Tratamento: combinação de Interferon a- peguilada (INF-a-peg) e ribovirina, com doses semanais de INF-a-peg e diária de ribovirina. O genótipo do vírus e a carga viral pré-tratamento são preditivos da resposta terapêutica, tendo o genótipo 1 tem pior resposta ao tratamento.

Adaptado de Ferreira, A.W., et al., 2013.
S = cadeia simples; d = cadeia dupla; ORF = faze de leitura; HCC = carcinoma hepatocelular. aGenótipos do HAV I, II, III e VII, considerado apenas em humanos. bAcima de 20% durante o terceiro trimestre de gravidez.
Referência
FERREIRA, A. W.; MORAES, S. L. Diagnóstico Laboratorial das Principais Doenças Infecciosas e Autoimunes: correlações clínico-laboratoriais. 3. ed. Rio de Janeiro: Guanabara Koogan, 2013. 477 p.
3 notes
·
View notes
Text
Testes da Função Renal
1. Testes de Filtração Glomerular
Testes de Depuração (Clearence): medem a taxa ou rapidez com que os rins conseguem remover (depurar) uma substância filtrável do sangue.
A substância utilizada para medição pode estar normalmente presente no organismo (procedimento endógeno) ou ser infundida no organismo (procedimento exógeno). Para assegurar que a filtração glomerular está sendo medida com precisão, a substância-teste de escolha deve, preferencialmente, seguir os seguintes critérios:
Não deve ser reabsorvida ou secretada pelos túbulos;
Deve ser estável na urina durante um possível período de coleta de 24h;
Deve ter nível plasmático constante.
Fórmula-padrão de depuração:
C = U x V
P
C = militros de plasma depurados por minuto (mL/min)
U = substância na urina (mg/dL), por exemplo creatinina
V = volume urinário (mL/min)
P = substância no plasma (mg/dL), por exemplo creatinina
a) Depuração da Ureia: utilizada nos primeiros testes, atualmente foi substituída por outras substâncias-teste.
Vantagens: presente nas amostras de urina de todas as espécies e disponibilidade de métodos de análise química utilizados rotineiramente.
Desvantagens: aproximadamente 40% da ureia filtrada é reabsorvida pelos túbulos. Os valores normais eram ajustados para refletir essa reabsorção, sendo os pacientes hidratados para produzirem um fluxo urinário de 2mL/min, garantindo que não mais de 40% da ureia fosse reabsorvida.
b) Depuração de Inulina (polímero de frutose):
Vantagens: substância estável, não reabsorvida ou secretada pelos túbulos.
Desvantagens: não está normalmente presente no organismo, havendo a necessidade da infusão intravenosa em velocidade constante durante o período do exame.
c) Injeção de Radionucleotídeos:
Vantagens: além de determinar a filtração glomerular pelo desaparecimento do material radioativo do plasma, possibilita a visualização da filtração em um ou ambos os rins. Dispensa a coleta de urina.
Desvantagem: não está normalmente presente no organismo.
d) b2-microglobulina: dissocia-se dos antígenos dos leucócitos humanos em velocidade constante e é rapidamente removida do plasma por filtração glomerular. Dosada através de ensaio imunoenzimático.
Vantagens: aumento no nível plasmático é indicador mais sensível da taxa de filtração glomerular do que a diminuição da depuração de creatinina. Dispensa a coleta de urina.
Desvantagem: teste não é confiável em pacientes com história de doenças imunológicas ou neoplasia.
e) Cistina C: é produzida a uma taxa constante por todas as células nucleadas e é facilmente filtrada pelo glomérulo, reabsorvida e metabolizada pelas células tubulares renais.
Vantagens: não é secretada pelos túbulos e a concentração sérica pode ser diretamente relacionada à taxa de filtração glomerular. Dispensa a coleta de urina. Testes de imunoensaios estão disponíveis para sua medição. O acompanhamento dos níveis de cistina C é recomendado para pacientes pediátricos, para pessoas com diabetes, para idosos e para pacientes criticamente enfermos.
f) Depuração da Creatinina: teste mais utilizado atualmente para avaliar a velocidade de filtração glomerular. É realizado através da dosagem da creatinina em uma amostra de urina colhida em um tempo determinado (volume/minuto) e também em uma amostra de sangue colhida durante o período de colheita da amostra de urina.
Significado Clínico: (1) monitorar a extensão dos danos aos néfrons em casos conhecidos de doença renal ou com risco de doença renal; (2) monitorar a viabilidade da administração de medicamentos que exigem adequada depuração renal e a eficácia do tratamento. NÃO serve para a detecção precoce de doença renal, pois a taxa de filtração glomerular é determinada não só pelo número de néfrons em funcionamento, mas também pela sua capacidade funcional. Assim, apesar de metade dos néfrons poder ser não funcional, uma mudança na taxa de filtração glomerular não ocorrerá se os néfrons restantes dobrarem sua capacidade de filtração.
Vantagens: é um produto do metabolismo muscular, encontrada em nível relativamente constante no sangue, fornecendo ao laboratório um processo endógeno para avaliar a função glomerular.
Desvantagens: alguma creatinina é secretada pelos túbulos e essa secreção aumenta com o aumento dos níveis sanguíneos; a creatinina urinária será degradada por bactérias se as amostras forem mantidas em temperatura ambiente por muito tempo; a grande ingestão de carne durante o período de colheita da urina de 24h poderá influenciar os resultados se a amostra de plasma for obtida antes do período da coleta; a depuração da creatinina não é um indicador confiável em pacientes portadores de doenças que resultem em distrofia muscular. Por esses inconvenientes, os resultados anormais podem ser seguidos por outros testes mais sofisticados, sendo a depuração de creatinina um método de triagem para avaliar a taxa de filtração glomerular.
Algumas fórmulas foram desenvolvidas para estimar a taxa de filtração glomerular com base na creatinina sérica, sem a urina creatinina. A fórmula mais utilizada foi desenvolvida por Cockcroft & Gault, contendo as seguintes variáveis originais: idade, gênero e peso corporal em quilogramas. Para fazer o cálculo acesse o site da Sociedade Brasileira de Nefrologia: http://www.sbn.org.br/equacoes/eq1.htm
Clearence de Creatinina (mL/min) = [140 – idade(anos)] x peso(Kg)
Creatinina plasmática (mg/dL) x 72
Para homens: resultado x 1
Para mulheres: resultado x 0,85
Uma nova fórmula, chamada de Modificção da Dieta em Doença Renal (Modification of Diet in Renal Disease – MDRD), utiliza variáveis adicionais, com a vantagem de não incluir o peso corporal, podendo ter o cálculo realizado automaticamente pelo instrumento que realiza a dosagem de creatinina. As variáveis incluem: etnia, nitrogênio ureico e albumina séricos.
2. Testes de Reabsorção Tubular
A reabsorção tubular é, muitas vezes, a primeira função afetada da doença renal.
Testes de Concentração: ensaios para determinar a capacidade de os túbulos reabsorverem os sais essenciais e a água que foram filtrados não seletivamente pelo glomérulo.
O ultrafiltrado que entra nos túbulos tem densidade específica = 1,010; portanto, depois da reabsorção, espera-se que a urina final seja mais concentrada. Vale notar, no entanto, que a concentração urinária é, em grande parte, determinada pela hidratação corporal, de modo que muitos indivíduos que não apresentam doença renal podem não ter uma densidade urinária maior que 1,010 ao exame de urina de rotina, pois o rim normal apenas reabsorverá a quantidade de água para manter o abastecimento corporal adequado. Portanto, o controle de fluidos deve ser incorporado em testes laboratoriais que medem a capacidade de concentração do rim.
a) Osmolaridade
Significado Clínico: (1) avaliação inicial da capacidade renal de concentração; (2) acompanhamento do curso da doença renal; (3) monitoramento terapêutico de fluidos e de eletrólitos; (4) diagnóstico diferencial de hiponatremia e hipernatremia e (5) avaliação da secreção de HAD e da resposta deste. Essas avaliações podem exigir determinações da osmolaridade no soro e na urina.
A gravidade específica depende do número de partículas e da densidade dessas partículas presentes em uma solução. Para avaliar a capacidade de concentração renal, as substâncias de interesse são moléculas pequenas como sódio (peso molecular 23 Da) e cloreto (peso molecular 35,5 Da). No entanto, a ureia (peso molecular 60 Da) contribuirá mais para a gravidade específica que as moléculas de sódio e cloreto. Como essas três moléculas contribuem igualmente para a osmolaridade da amostra, uma avaliação mais representativa da capacidade renal de concentração pode ser obtida pela medida da osmolaridade.
Lembre-se que 1 osmol é definido como 1 g de peso molecular de uma substância, dividido pelo número de partículas nas quais ela se dissocia. Uma substância não ionizável como a glicose (peso molecular 180 Da) contém 180 g por mol, enquanto o cloreto de sódio (NaCl) (peso molecular 58,5 Da), se completamente dissolvido, contém 29,25 g por mol. A unidade de medida utilizada no laboratório é o miliosmol (mOsm), porque não é prática a utilização de unidades tão grandes quanto o osmol (23 g se sódio por litro ou por quilograma).
A osmolaridade de uma solução pode ser determinada pela medida de uma propriedade, que é matematicamente relacionada com o número de partículas na solução (propriedade coligativa), e comparando esse valor com o obtido a partir do solvente puro. Um soluto dissolvido em solvente provoca as seguintes alterações nas propriedades coligativas: (1) rebaixamento do ponto de congelamento; (2) elevação do ponto de ebulição; (3) aumento da pressão osmótica e (4) rebaixamento da pressão de vapor. Como a água é solvente em ambos, urina e plasma, o número de partículas em uma amostra pode ser determinado comparando-se o valor de uma propriedade coligativa da amostra com o da água pura. Instrumento estão disponíveis no laboratório clínico para medir o rebaixamento do ponto de congelamento e o rebaixamento da pressão de vapor.
Valores normais:
Osmolaridade sérica = 275 a 300 mOsm;
Osmolaridade urinária = 50 – 1400 mOsm2 (valores difíceis de serem estabelecidos pois são influenciados por fatores como ingestão de fluidos e exercícios);
Osmolaridade urinária/sérica = 1:1, pelo menos, ou 3:1 após ingestão de fluidos. Essa relação, em conjunto com a ingestão controlada de líquidos e injeção de HAD, é utilizada para diferenciar se o diabetes insipidus é provocado pela diminuição da produção de HAD (ocorre concentração urinária após injeção de HAD) ou por incapacidade dos túbulos renais de responder ao HAD (incapacidade de atingir 3:1 após injeção de HAD). Teste para medir, diretamente, a concentração de HAD no plasma e na urina estão disponíveis para o diagnóstico de casos difíceis.
b) Depuração de Água Livre
Significado Clínico: (1) determinar a capacidade do rim para responder ap estado de hidratação corporal.
A relação da osmolaridade urinária/sérica pode ser ampliada pela análise que utiliza restrição de água e amostra de urina colhida por tempo cronometrado para o cálculo da depuração de água livre. Inicialmente, faz-se o cálculo da depuração osmolar (através da fórmula-padrão de depuração) e, então, subtrai-se este do volume urinário:
Cosm (mL/min) = Osm urinária (mOsm)(U) x Vol urinário (mL/min)(V)
Osmolaridade plasmática (mOsm)(P)
CH2O = Volume urinário (mL/mim) - Cosm
O cálculo da depuração osmolar indica quanta água deve ser depurada a cada minuto para produzir urina com a mesma osmolaridade plasmática. O ultrafiltrado contém a mesma osmolaridade plasmática e, portanto, as diferenças osmóticas na urina são resultado dos mecanismos renais de concentração e de diluição. Comparando-se a depuração osmolar com o volume urinário excretado por minuto, pode-se determinar se a água excretada é mais (resultado positivo) ou menos (resultado negativo) que o montante necessário para manter a mesma osmolaridade que a do ultrafiltrado. Dessa forma, um resultado negativo indica que uma quantidade de água menor que a necessária está sendo excretada, um possível estado de desidratação, enquanto um resultado positivo indica um excesso de água sendo excretado. Se o resultado fosse 0,0 (zero), a concentração ou a diluição renal não seria realizada.
3. Testes de Secreção Tubular e Fluxo Sanguíneo Renal
O fluxo sanguíneo real total através do néfron deve ser medido por uma substância que é secretada e não filtrada pelo glomérulo. A capacidade secretora tubular.
a) Teste do Ácido p-aminohipúrico (PAH)
Para medir exatamente a quantidade de sangue que flui através dos rins, utiliza-se uma substância que seja completamente removida do sangue (plasma) cada vez que entrar em contato com o tecido renal funcional. O princípio é o mesmo que na depuração para o teste de filtração glomerular, no entanto, a substância deve ser removida do sangue principalmente nos capilares peritubulares, em vez de ser removida quando o sangue atinge o glomérulo.
Vantagens: substância não é tóxica; liga-se fracamente às proteínas plasmáticas, o que permite sua remoção completa quando o sangue passa através dos capilares peritubulares; exceto por uma pequena quantidade de PAH no plasma que não entra em contato com o tecido renal funcional (cerca de 8%), todo o PAH plasmático é secretado pelo túbulo contornado proximal. Portanto, o volume de plasma que flui através dos rins determina a quantidade de PAH excretada na urina.
Desvantagem: não está normalmente presente no organismo. A quantidade de PAH infundida deve ser monitorada.
A fórmula padrão de depuração pode ser utilizada para o cálculo do fluxo plasmático efetivo renal (termo “efetivo” é incluído porque pequena parte do fluxo sanguíneo renal não entra em contato com o tecido renal funcional).
CPAH (mL/min) = PAH urinário (mg/dL)(U) x Vol urinário (mL/min)(V)
Osmolaridade plasmática PAH (mg/dL)(P)
Valores normais:
Baseado em leituras normais de hematócrito, fluxo plasmático renal efetivo = 600 – 700 mL/min, sendo a média de fluxo sanguíneo renal = 1200 mL/min.
b) Acidez Titulável e Amônia Urinária
Medidas de pH urinário, de acidez titulável e da amônia urinária. A diferença entre a titulação da quantidade de H+ livre (acidez titulável) e a acidez total da amostra, resulta na concentração de amônio.
A capacidade do rim produzir urina ácida depende de dois fatores: (1) secreção tubular de íons hidrogênio pelo túbulo contornado próxima e (2) produção e secreção de amônia pelas células do túbulo contornado distal. A incapacidade de produzir urina ácida na presença de acidose metabólica é denominada acidose tubular renal e pode resultar da secreção tubular de íons hidrogênio associada ao túbulo contornado proximal diminuída ou defeitos na secreção de amônia associada ao túbulo contornado distal.
Valores normais:
Uma pessoa normal excreta cerca de 70 mEq/dia de ácido na forma de acidez titulável (H+), íons hidrogênio fosfato (H2PO4-) ou íons amônio (NH4+). A variação diurna normal de acidez urinária é decorrente de marés alcalinas, logo após a pessoa se levantar e nos períodos pós-prandial e, aproximadamente, às 14h e às 20h. O menor pH é encontrado durante a noite.
Referência
STRASINGER, S. K.; DI LORENZO, M. S. Urinálise e Fluidos Corporais. 5. ed. São Paulo: Livraria Médica Paulista, 2009. 329 p.
2 notes
·
View notes
Text
Fisiologia Renal
Figura 1. Sistema excretor humano. Extraído de http://www.ocorpohumano.com.br/index1.html?http://www.ocorpohumano.com.br/s_excretor.htm acesso em 30/12/2014.
Figura 2. Morfologia interno do rim. Extraído de http://www.ocorpohumano.com.br/index1.html?http://www.ocorpohumano.com.br/s_excretor.htm acesso em 30/12/2014.
Cada rim humano contém cerca de 1 a 1,5 milhão de néfrons; 85% são néfrons corticais, situados, principalmente, no córtex do rim, sendo responsáveis pela remoção de resíduos e pela reabsorção de nutrientes e 25% são néfrons justamedulares, com alças de Henle profundas que se estendem para a medula do rim, sendo responsáveis pela concentração da urina. A capacidade dos rins de excretar seletivamente os resíduos do sangue e de manter o balanço hidroeletrolítico é controlada nos néfrons pelas funções renais: fluxo sanguíneo renal, filtração glomerular, reabsorção tubular e secreção tubular.
1. Fluxo Sanguíneo Renal
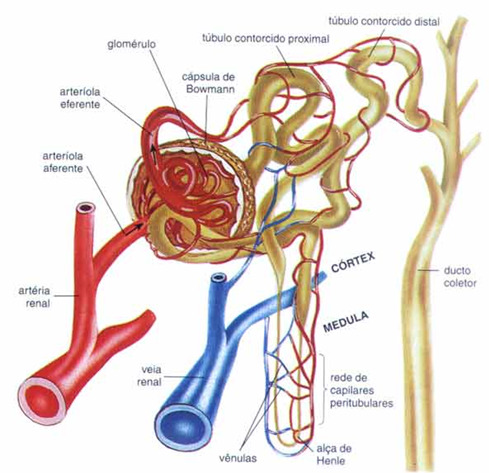
Figura 3. Fluxo sanguíneo renal. Extraído de http://www.ocorpohumano.com.br/index1.html?http://www.ocorpohumano.com.br/s_excretor.htm acesso em 30/12/2014.
Para uma superfície corporal média de 1,73m2, o fluxo sanguíneo total nos rins é cerca de 1200 mL/min e segue o seguinte percurso:
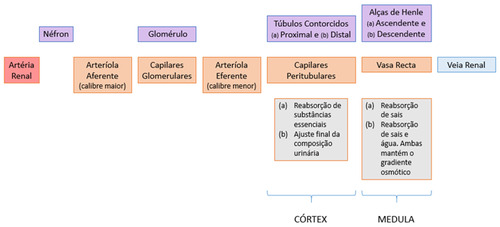
A artéria renal fornece sangue para o rim. O sangue entra nos capilares do néfron pela arteríola aferente e flui através do glomérulo para a arteríola eferente. As diferentes dimensões dessas arteríolas ajudam a criar a pressão hidrostática diferencial importante para manter o fluxo sanguíneo no glomérulo e a filtração glomerular; o menor tamanho da arteríola eferente aumenta a pressão capilar glomerular.
O sangue da arteríola aferente entra nos capilares peritubulares e na vasa recta e flui lentamente através do córtex e da medula do rim, próximo dos túbulos. Os capilares peritubulares circundam os túbulos contornados proximais e distais, o que permite a reabsorção de substâncias essenciais do fluido do túbulo contornado proximal e o ajuste final da composição urinária do túbulo contornado distal. A vasa recta está adjacente aos ramos ascendente e descendente da alça de Henle nos néfrons justamedulares. Nessa área ocorrem as principais trocas de água e de sais entre o sangue e o interstício medular, mantendo o gradiente osmótico na medula, necessária para a concentração renal.
2. Filtração Glomerular
O glomérulo é constituído por cerca de oito lobos capilares (tufo capilar) e é envolto pela cápsula de Bowman, funcionando como um filtro NÃO seletivo de substâncias plasmáticas com peso molecular inferior a 70000. Entre os fatores que influenciam o processo de filtração estão:
a) Estrutura Celular do Glomérulo
O filtrado plasmático deve passar por três camadas celulares: (1) membrana da parede capilar, cujas células endoteliais, diferentemente da parede dos outros capilares, têm poros (fenestras) que aumentam a permeabilidade capilar, mas não permitem a passagem de moléculas grandes e de células sanguíneas; (2) membrana basal (lâmina basal); (3) epitélio da cápsula de Bowman, que tem entrelaçamentos dos pedicelos dos podócitos, formando membranas finas que cobrem as fendas de filtração.
b) Pressão Glomerular
A filtração é intensificada pela presença da pressão hidrostática criada pelo tamanho menor das arteríolas eferentes e dos capilares glomerulares, necessária para vencer a oposição das pressões do fluido no interior da cápsula de Bowman e da pressão oncótica das proteínas plasmáticas não filtradas nos capilares glomerulares.
Mecanismos autorregulador nos rins, dentro do aparelho justaglomerular: mantém-se a pressão arterial glomerular independentemente das flutuações da pressão arterial sistêmica através do aumento ou da redução do tamanho da arteríola aferente. Quando a pressão arterial cai, ocorre a dilatação das arteríolas aferentes e a constrição das arteríolas eferentes, impedindo a queda acentuada no fluxo de sangue através dos rins, evitando o aumento do nível sanguíneo de resíduos de produtos tóxicos; quando a pressão arterial aumenta, ocorre a contrição da arteríola aferente para evitar excesso de filtração ou danos ao glomérulo.
c) Sistema Renina-Angiotensina-Aldosterona (SRAA)
Esse sistema é ativado em resposta às alterações na pressão sanguínea e nos níveis plasmáticos de sódio, detectados pela mácula densa no aparelho justaglomerular. O baixo teor de sódio plasmático diminui a retenção hídrica do sistema circulatório, diminuindo o volume sanguíneo e a pressão arterial. Quando a mácula densa detecta essas mudanças, secreta renina (enzima produzida pelas células justaglomerulares), que reage com angiotensinogênio (substrato inerte) para produzir angiotensina I (hormônio inerte). Nos pulmões, angiotensina I é metabolizada pela enzima conversora da angiotensina (ECA) para a forma ativa angiotensina II (hormônio ativo). A angiotensina II corrige o fluxo sanguíneo renal através de: (1) vasodilatação das arteríolas aferente e constrição das arteríolas eferentes; (2) reabsorção de sódio nos túbulos contornados proximais; (3) liberação de aldosterona (hormônio retentor de sódio) pelo córtex da adrenal e de hormônio antidiurético pelo hipotálamo. À medida que a pressão arterial sistêmica e o conteúdo plasmático de sódio aumentam, diminui a secreção de renina. Assim, as ações de angiotensina II produzem pressão constante dentro dos néfrons.
Como resultado, a cada minuto, cerca de dois a três milhões de glomérulos filtram, aproximadamente, 120 mL de água, com substâncias de baixo peso molecular. Como se trata de uma filtração não seletiva, a única diferença entre as composições do filtrado e do plasma é a ausência de proteínas plasmáticas, quaisquer substâncias ligadas a elas e células. O filtrado tem densidade específica de 1,010, confirmando que é um ultrafiltrado do plasma.
3. Reabsorção Tubular (substâncias essenciais e água do filtrado para o sangue)
Quando o ultrafiltrado plasmático entra no túbulo contornado proximal, os néfrons, através de transporte ativo e passivo, começam a reabsorver substâncias essenciais e água. Para que ocorra o transporte ativo, a substância a ser reabsorvida deve combinar-se a uma proteína transportadora contida nas membranas das células tubulares renais, gerando uma energia eletroquímica que transfere a substância através da membrana celular de volta à circulação sanguínea. No transporte passivo, a substância é transportada pelas diferenças (gradientes) de concentração ou de potencial elétrico. A reabsorção passiva de água ocorre em todas as partes do néfron, exceto no ramo ascendente da alça de Henle, pois as paredes são impermeáveis à água. Tanto o transporte ativo quanto o passivo podem ser influenciados pela concentração da substância a ser transportada. Quando a concentração plasmática de uma substância que, em geral, é completamente reabsorvida atinge um nível anormalmente elevado, a concentração no filtrado excede a capacidade reabsortiva máxima (Tm) dos túbulos e a substância começa a aparecer na urina. A concentração plasmática que satura o transporte ativo é denominada limiar renal. Por exemplo, para a glicose, o limiar renal é de 160 a 180 mg/dL, e ela aparece na urina quando a concentração plasmática atinge esse nível. O conhecimento do limiar renal e da concentração plasmática pode distinguir o excesso de filtração de soluto do dano tubular renal. Assim, o aparecimento de glicose na urina de uma pessoa com nível normal de glicose sanguínea é o resultado de dano tubular e na de diabetes mellitus.
2.1 Túbulo Contornado Proximal: início da reabsorção do ultrafiltrado plasmático.
a) Transporte Ativo: reabsorção de glicose, de aminoácidos e de sais.
b) Transporte Passivo: reabsorção de água e de ureia.
O transporte ativo de mais de 2/3 do sódio filtrado pelo túbulo contornado proximal é acompanhado pela reabsorção passiva de igual quantidade de água. Portanto, o fluido que sai do túbulo contornado proximal mantém a concentração do ultrafiltrado.
2.2 Alça Descendente de Henle: início da concentração renal, com exposição do filtrado ao alto gradiente osmótico (concentração de sal) da medula renal.
a) Transporte Passivo: reabsorção de água por osmose.
2.3 Alça Ascendente de Henle: reabsorção de sais.
a) Transporte Ativo: reabsorção de cloreto
b) Transporte Passivo: reabsorção de sódio e de ureia. Única região do néfron impermeável à água
A excessiva reabsorção de água quando o filtrado passa através da medula altamente concentrada é impedida pela impermeabilidade à água das paredes do ramo ascendente. Esse processo de reabsorção seletiva é chamado de mecanismo de contracorrente e serve para manter o gradiente osmótico da medula. A reabsorção de sódio e de cloreto do ramo ascendente evitam a diluição no interstício medular pela água reabsorvida a partir do ramo descendente. O filtrado que sai do ramo ascendente tem concentração baixa pela reabsorção de sais e não de água.
2.4 Túbulo Contornado Distal e Ducto Coletor: concentração final do filtrado, que depende do gradiente osmótico da medula e do hormônio antidiurético (ADH) ou vasopressina.
a) Transporte Ativo: reabsorção de sódio, mas agora sob controle do hormônio aldosterona.
b) Transporte Passivo: reabsorção de água pelo contato com a medula, regulada pelo HAD, cujo nível elevado torna as paredes do túbulo contornado distal e do ducto coletor permeáveis à água. A baixa hidratação corporal aumenta a liberação de HAD, que aumenta a permeabilidade, resultando em aumento da reabsorção de água e em urina concentrada e de baixo volume. Por outro lado, a hidratação corporal diminui a liberação de HAD, que torna as paredes impermeáveis à água, resultando em grande volume de urina diluída.
4. Secreção Tubular (substâncias do sangue (capilares peritubulares) para o filtrado tubular)
A secreção tubular tem duas funções principais: (a) eliminação de produtos residuais não filtrados pelo glomérulo e (b) regulação do equilíbrio ácido-básico do organismo através da secreção de íons hidrogênio.
No túbulo contornado proximal, principalmente, ocorre a filtração de substâncias ligadas a proteínas (não filtradas pelos glomérulos), que se dissociam das proteínas transportadoras ao entrar nos capilares peritubulares, pela alta afinidade às células tubulares, e são transportadas para o filtrado.
Para manter o pH sanguíneo normal de 7,4, o sangue precisa tamponar e eliminar o excesso de ácido formado pela ingestão dietética e pelo metabolismo. A capacidade tamponante do sangue depende de íons bicarbonato (HCO3-) que, também no túbulo contornado proximal, principalmente, são reabsorvidos através da excreção de íons hidrogênio. Os íons hidrogênio (H+) são excretadas ao se combinar com íons fosfato filtrados ou através da reação com a amônia (NH3+) para formar o íon amônio (NH4+), que é excretado na urina.
Referência
STRASINGER, S. K.; DI LORENZO, M. S. Urinálise e Fluidos Corporais. 5. ed. São Paulo: Livraria Médica Paulista, 2009. 329 p.
3 notes
·
View notes