Text
世界で初めてのヘモグロビン・サーモダイナミックス(11)
ヘモグロビンの協同性
ヘモグロビンの協同性とは、
4個のヘム機構を持つデオキシヘモグロビン1分子に、
1分子の酸素分子が配位すると次の酸素分子の配位する反応速度が加速され、
4分子の酸素分子が配位するまで反応速度の加速が連鎖すること、
及び、オキシヘモグロビン1分子から、
1分子の酸素分子が解離すると次の酸素分子の解離する反応速度が加速され、
4分子の酸素分子が解離するまで反応速度の加速が連鎖することです。
興味深いヘモグロビンの協同性については、
多大な経費と時間とをかけて様々な研究がなされた。
ポリフィリン環の平面性と非平面性との間で生ずるコンフォメーション変化が、
情報伝達機構になるとする説があります。
また、協奏的全て又は無の対称性保存モデル等が提唱されています。
ギブスエネルギー値は状態量であるから、始めの状態と終わりの状態とを定めると経路によらず一定になります。
それでもヘモグロビンの協同性は中間体を含む概念であるから、
反応経路上にある中間体を含めて論じる必要があります。
化学反応についての熱力学的支配と反応速度支配とは必ずしも一致しませんが、
へモグロビンの酸化還元反応はその中間体を含めて極めて類似する反応であるから、
それらの関係は強い相関を持っていると推定されます。
即ち、熱力学的支配関係から反応速度支配関係を予測することが可能であると解します。
反応速度支配の結果現れるヘモグロビンの協同性について、
熱力学的支配の見地から推定します。
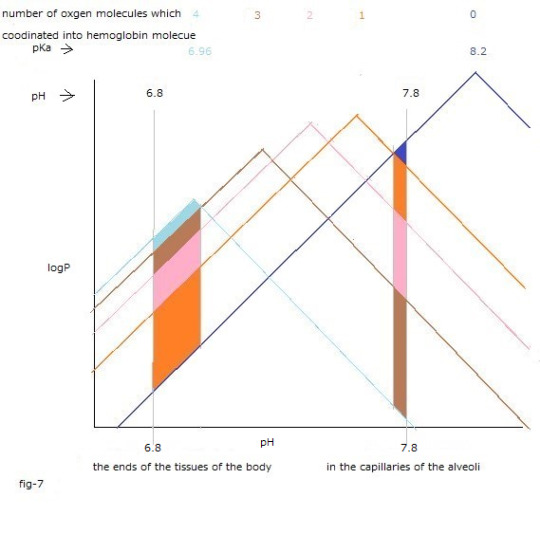
fig-7を見て下さい。
色塗りした部分を上から下に向かって読み取ります。
縦方向に長い程ギブスエネルギーの低下が大きくなります。
中間体である色塗りした下方部分のほうがギブスエネルギーの低下に大きく貢献しています。
肺胞の毛細血管内と体の組織の末端との双方に於いて、
1分子の酸素分子が反応を開始すると、
直ちに4分子の酸素分子が反応する様子が理解できます。
尚、全ての図は相対的な関係を示したものであり、
絶対値としての意味はないことに留意して下さい。

未完
参考文献:
生命科学系のための物理化学
Raymond Chang著 岩澤 康裕・北川 禎三・濱口 宏夫 訳
東京化学同人
エントロピーの正体 アリー・ベン=ナイム著 小野喜之 訳
丸善出版株式会社
ヘモグロビンへの配位子結合過程を直接観測 理化学研究所
足立 伸一 森本 宣嗣
https://www.riken.jp/medialibrary/riken/pr/press/2003/20030609_1/20030609_1.pdf
https://core.ac.uk/download/pdf/56655512.pdf
ヘム電子論によるヘモグロビンの協同的酸素結合機能の解明
山本 泰彦
ヘモグロビンのヘム間相互作用のメカニズム
森本 英樹(阪大基礎工) 今井 清博(阪大医)
蛋白質工学によるヘモグロビンの協同効果発現機序の研究
4次構造転移における特定水素結合の寄与
石森 浩一郎、森島 續、 今 井 清 博、 伏 谷 建 造、 宮 崎 源 太 郎、 森 本 英 樹、 北 川 禎 三、 和 田 芳 直、ShinD、Tame J、Pegnier J、 Nagai K
京都大学、大阪大学、大阪府母子医療センター、MRC. Lab. of Mol. Biol.
https://www.jstage.jst.go.jp/article/biophys1961/29/supplement/29_supplement_S45/_pdf
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (11)
Hemoglobin's cooperativity
Hemoglobin's cooperativity means that in one molecule of deoxyhemoglobin with 4 heme mechanisms,
after one oxygen molecule coordinates to one molecule of deoxyhemoglobin, the reaction rate of the next oxygen molecule accelerates,
and the chain accelerations of the reaction rate continue untill four oxygen molecules coordinate,
and after one oxygen molecule dissociates from one molecule of oxyhemoglobin,
the reaction rate of the next oxygen molecule accelerates,
and the chain accelerations of the reaction rate continue untill four oxygen molecules dissociate.
Great expense and time are consumed to study interesting hemoglobin's cooperativity.
There is a theory that the conformational change that occurs between the planarity and non-planarity of the polyphyllin ring becomes an mechanism of informational transmission .
In addition, a model of concerted all-or-none in which symmetry is conserved has been suggested.
Since the Gibbs energy value is a quantity of state, it will be constant regardless of the route by choosing the state of the beginning and the state of the end.
Still, hemoglobin's cooperativity is a concept that includes intermediates, so intermediates on the reaction path should be discussed.
Thermodynamics dominance and kinetic dominance of chemical reactions do not always coincide.
Since the redox reactions of hemoglobin are extremely similar reactions including its intermediates, their relationship of dominances has been presumed to be strongly correlated.
In other words, it is possileto predict the reaction rate dominance relationship from the thermodynamic dominance relationship.
The hemoglobin's cooperativity that appears as a result of reaction rate domination is estemated from the point of view of thermodynamics dominance.
See fig-7.
Read the colored area from top to bottom.
The longer it is in the vertical direction, the greater the decrease in Gibbs energy value.
The intermediates that are lower parts of the colored area contribute significantly to the reduction of Gibbs energy value.
It's comprehensible that no sooner has one oxygen molecule begun to react than four oxygen molecules react in both the capillaries of the alveoli and the ends of tssues of the body.
All figures show relative relationships.
Please note that they don't have any meanings as an absolute values.
unfinished
Reference:
Physical Chemistry for the Bioscience Written by Raymond Chang Translated by Iwasawa Yasuhiro, Kitagawa Teizou, Hamaguchi Hiroo TOKYOKAGAKUDOJIN Co., Ltd.
ENTROPY AND THE SECOND LAW Written by ARIEH BEN-NAIM Translated by Ono Yoshiyuki Maruzen-publishing Co.,Lid
Direct observation of ligand binding processes to hemoglobin
RIKEN Japan's flagship institute for natural science research.
Adachi Shinnichi Morimoto Noritsugu
https://www.riken.jp/medialibrary/riken/pr/press/2003/20030609_1/20030609_1.pdf
Elucidation of the cooperative oxygen binding function of hemoglobin by heme electron theory
Yamamoto Yasuhiko
https://core.ac.uk/download/pdf/56655512.pdf
Mechanism of heme-heme interaction of hemoglobin
Morimoto Hideki (Osaka University) Imai Kiyohiro(Osaka University)
Study of the mechanism of cooperarive effect of hemoglobin by protein engineering
Contribution of Specific Hydroen Bonds in Fouth-Order Structural Transtion
Ishimori Koichiro, Morishima Akira, Imai Kiyohiro, Fushitani Kenzo, Miyazaki Gentaro, Wada Yoshinao, Shin D, Tame J, Pegnier J, Nagai K
Kyoto University, Osaka University, Osaka Prefectural Maternal and Child Medical Center, MRC.Lab. of Mol. Biol.
https://www.jstage.jst.go.jp/article/biophys1961/29/supplement/29_supplement_S45/_pdf
https://www.jstage.jst.go.jp/article/biophys/41/2/41_2_74/_pdf/-char/ja
#hemoglobin#oxyhemoglobin#deoxyhemoglobin#coordinate#dissociate#chain accelerations#domination#polyphyllin ring#Gibbs energy#hemoglobin's cooperativity
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (6)
書き換えた"世界で初めてのヘモグロビン・サーモダイナミックス(6)"
血液のpH値は6.8~7.8
(4)デオキシヘモグロビンAのpKaは8.2
(2)オキシヘモグロビンAのpKaは6.96
(1)logP₀と(2)logP₀または(3)logP₀と(4)logP₀は近似するものと想定します。
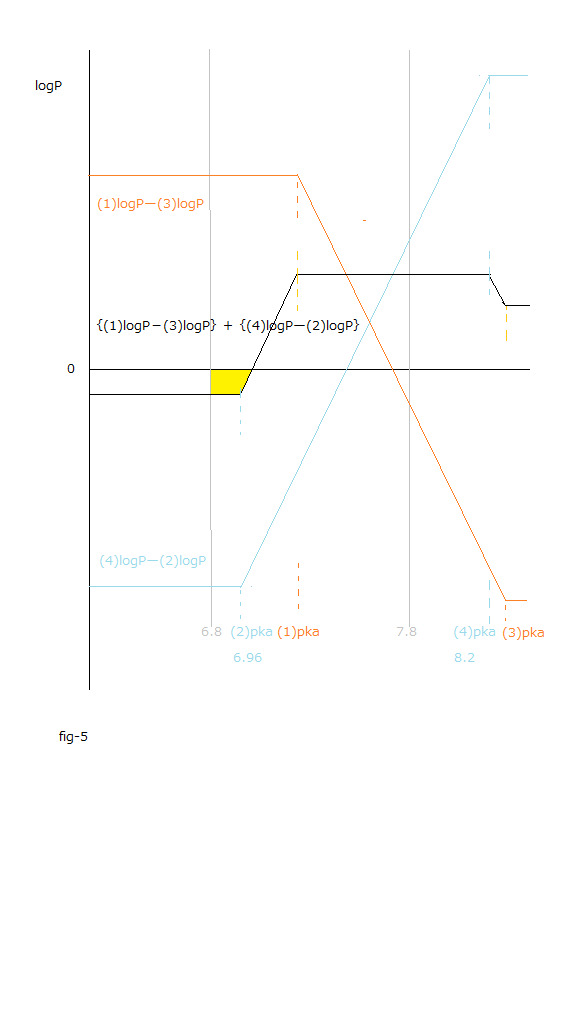
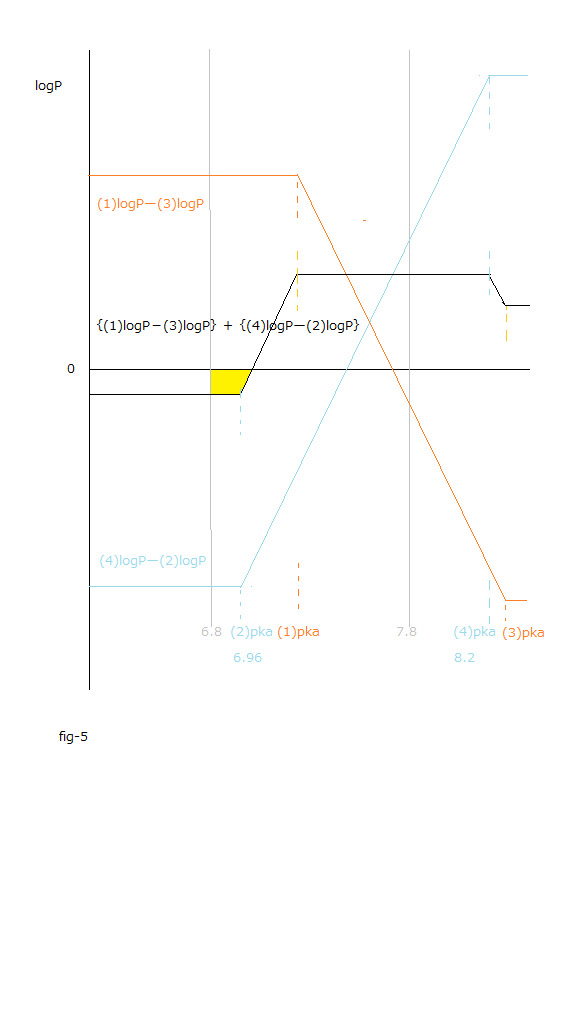
fig-5の黄色の領域
fig-5の黄色の領域は6.8≦pH≦7.8で、
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]≦ 0である領域です。
斯かる領域は血液のpH値内 (6.8~7.8)で、 かつ ΔrG₀aqtotal 値変化の総和 が 0 以下となる領域です。
fig-5の黄色の領域内で(2)オキシヘモグロビンAから(3)デオキシミオグロビンへの酸素分子の移動は自発的です。
その領域でΔrG₀total ≦ 0になります。 ΔrG₀total = ΔrG₀aqtotal であるから、
その時aq層の溶質のギブスエネルギー値変化の総和 も負になります。 ΔrG₀aqtotal ≦ 0
fig-5の黄色の領域内で、
(2)オキシヘモグロビンAと(3)デオキシミオグロビンとから、
(4)デオキシヘモグロビンAと(1)オキシミオグロビンとへ��反応は、
自発的になります。
人の血液のpH値の範囲内(6.8 ~7.8)では低pH値の領域に属する体の末端の組織内で、
(1)オキシミオグロビンが生成してその中の酸素分子は代謝過程に使われます。
fig-5の黄色の領域内での酸素分子の移動を伴う化学反応に基づくギブスエネルギー値の変化の総和は、事実上相殺関係にあることから考慮しないものとしました。
pH値の変動によるギブスエネルギー値の変動
異なるpKa値(pI値)を有する溶質の間では、pH値の変動による溶媒和の大きさの変動が同じではないことから、
pH値の変動によるギブスエネルギー値の総和の変動を考慮の対象としました。
当該反応の出発物質のpKa値(pI値)と生成物のpKa値(pI値)が異なることから、
pH値の変動によるそれらの溶媒和の大きさが異なることに基づいて、
ギブスエネルギー値の総和も変動することを考慮の対象としました。
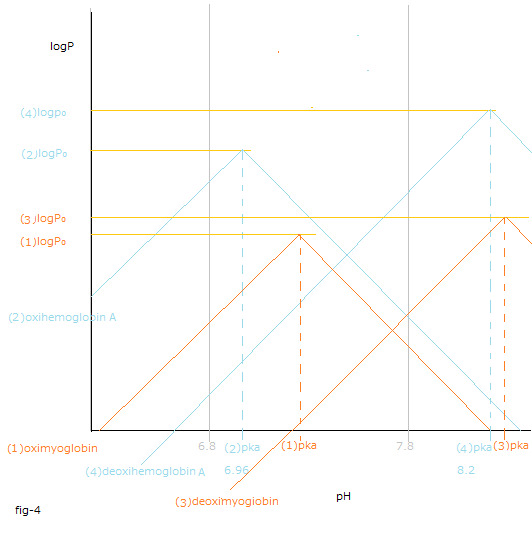
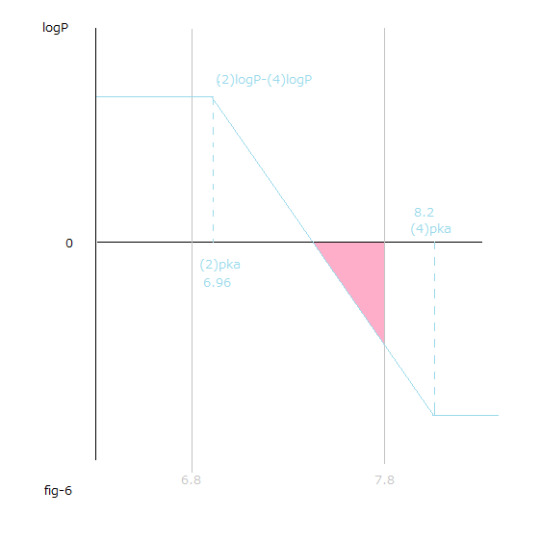
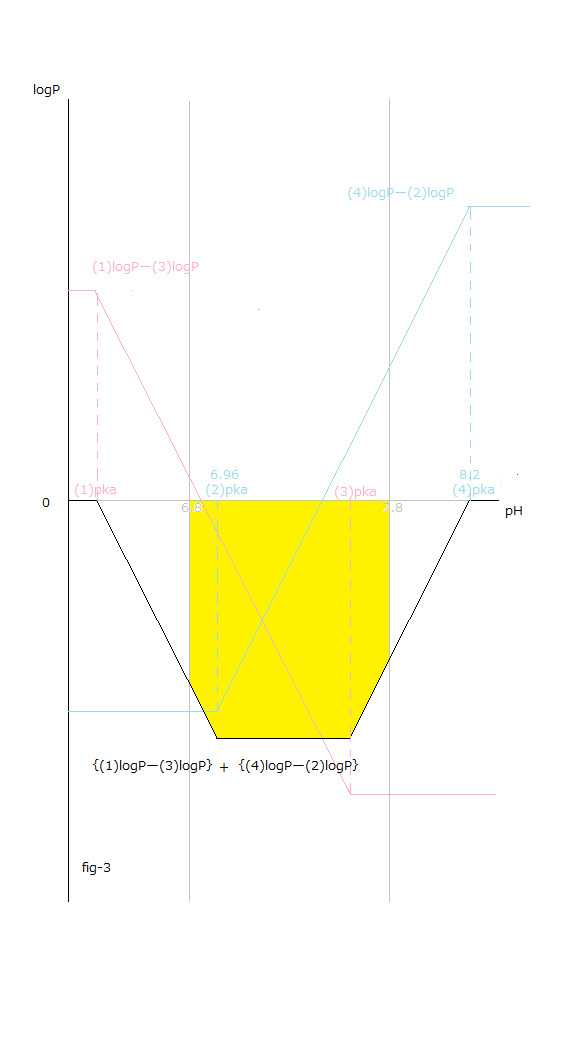
fig-4を見て下さい。上記の意味が解り易くなります。
(4)デオキシヘモグロビンAと酸素分子とから(2)オキシヘモグロビンAを生成する反応。
fig-4の(2)logPと(4)logPとが交差する点の右側のpH値の領域でΔrG₀total値変化の総和 が負の値になります。
fig-6に ー{(4) logPー(2)logP} = (2)logPー(4)logP を示してあります。
fig-6のピンク色の領域内で (2)logPー(4)logP < 0 が成立します。
fig-6のピンク色の領域は人の血液のpH値の範囲内のうちで高pH値の領域です。
fig-6のピンク色の領域内でΔrG₀total=ー2.3RT {(4) logPー(2)logP} = 2.3RT[(2)logPー(4)logP]<0 なので、
水溶液中における溶質のギブスエネルギー値変化の総和(ΔrG₀aqtotal<0)も負になります。
fig-6のピンク色の領域内でΔΔrG₀totalは負です。
この時のΔΔrG₀aqtotalも同じ絶対値において負の値になるので、
fig-6のピンク色の領域を右側に移動するとΔrG₀aqtotal値変化総和 である負の値の絶対値は大きくなります。
(4)デオキシヘモグロビンAと酸素分子とから、
(2)オキシヘモグロビンAを生成する際に、
高スピンFe++錯体から低スピンFe++錯体への転換を伴っている事等から、
溶媒和を考慮しない反応ギブスエネルギー値の変化は負の値です。
溶媒和を考慮した反応ギブスエネルギー変化も負の値です。
それら負の値の和は負の値になるので、
肺においてデオキシヘモグロビンA(4)と酸素分子とから、
オキシヘモグロビンA(2)を生成する反応は、
速やかに進行する自発的なものになります。

0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (6).
A rewrite of "The first thermodynamics in the world with regard to hemoglobin (6)."
The pH of human blood is 6.8~7.8,
the pKa of (4)deoxyhomoglobinA is 8.2,
the pKa of (2)oxyhomoglobinA is 6.96,
it assumed that(1)logP₀ and (2)logP₀ or (3)logP₀ and (4)logP₀ are approximately the same value.
The yellow region in fig-5
The yellow region in fig-5 is the region of 6.8≦pH≦7.8.
and the region of ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]≦ 0
This region is within the pH value of human blood(6.8~7.8) and the sum total of Gibbs energy changes is less than 0.
Within the yellow region in fig-5 the transfer of oxygen molecules to (3)deoxymyoglobin from (2)oxyhemoglobinA is spontaneous.
The sum total of ⊿G₀ changes in that region is less than 0. ΔG₀total≦0
At that time the Gibbs energy change of solute in the aq layer ΔrG₀aqtotal is also less than 0, due to ΔG₀total = ΔrG₀aqtotal
Within the yellow region in fig-5 the reaction from (2)oxyhemoglobinA and (3)deoxymyoglobin to (4)deoxyhemoglobinA and (1)oxymyoglobin is spontaneous.
In the terminal tissues of the body which belong to the area of low pH value within the pH value range of human blood,
(1)oxymyoglobin is formed and the oxygen molecule in it is used in metabolic processes.
Within the yellow region in fig-5 the sum total of changes in Gibbs energy values based on chemical reactions involving the movement of oxgen molecules has not been taken into consideration, due to the sum total is effectively in a cancelling out relationship.
Gibbs energy values due to fluctuations in pH values
Since the variation in magnitude of solvation due to fluctuations in pH values are not the same between the solutes having different pKa values(pI values), the variations in the sum total of Gibbs energy values due to fluctuations in pH values are taken into consideration.
See fig-4. The drawing fig-4 makes it easier for you to understand the meaning mentioned above.
The reaction to form (2)oxyhemoglobinA from (4)deoxyhomoglobinA and the oxygen molecules.
The sum total of logP value change are negative in the region of pH value to the right of the point where (2)logP and (4)l.ogP intersect in fig-4.
ー {(4) logPー(2)logP} = (2)logPー(4)logP is shown in fig-6.
The inequality relation (2)logPー(4)logP <0 is established in pink region in fig-6.
The pink region in fig-6 is the range with a high pH value within the pH region of human blood.
Since the sum total of ⊿rG₀ in that region ΔrG₀total is negative(ΔrG₀total=ー2.3RT {(4) logPー(2)logP} = 2.3RT[(2)logPー(4)logP]<0 ), the changes in Gibbs energy of the solute in the aq layer(ΔrG₀aqtotal<0) is also negative.
ΔΔrG₀total is negative (ΔΔrG₀total <0 )in pink region of fig-6. Since ΔΔrG₀aqtotal at this time is also negative at the same absolute values,
in the pH value region to the right of the point where (2)logP and (4)logP intersect in fig-4, the absolute value of negative values, which is the sum total of change in ΔrG₀aqtotal values, increases.
When (2)oxyhemoglobinA is formed from (4)deoxyhemoglobinA and the oxygen molecules,
Since it involves the conversion from a high-spin Fe++ complex to a low- spin Fe++ complex, the changes of reaction Gibbs energy values that are not taken the solvation into the consideration are also negative.
The reaction Gibbs energy changes considering solvaion are also negative.
Since the sum total of these negative values is negative, the reaction from (4)deoxyhemoglobinA and the oxygen molecules to form (2)oxyhemoglobinA is spontaneous one with quick process.
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (5)
書き換えた"世界で初めてのヘモグロビン・サーモダイナミックス(5)"
(2)オキシヘモグロビンAから(3)デオキシヘモグロビンFへの酸素分子の移動
Aはお母さんを含む大人(Adult)を意味し、Fは胎児(Fetus)を意味します。
お母さんから胎児への酸素分子の移動が自発過程であることについて説明します。
人の血液のpHは6.8~7.8、
(4)デオキシヘモグロビンAのpKaは8.2、
(2)オキシヘモグロビンAのpKaは6.96、
(1)logP₀と(2)logP₀または(3)logP₀と(4)logP₀は近似するものと想定します。
お母さんから胎児に酸素分子が移動する際、
(2)オキシヘモグロビンAと(3)デオキシヘモグロビンFとから
(4)デオキシヘモグロビンAと(1)オキシヘモグロビンFとを生じます。
そして、その酸素分子が移動する際に生ずるギブスエネルギー変化(⊿G)の総和(ΔrG₀total )が負の値になることを説明します。
⊿G=ーRTlnP=ー2.3RTlogPであるからlogPについて論じることで⊿Gについての判断が可能となります。
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0
ΔrG₀total = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0
(1)pKa以下のpH領域及び(4)pKa以上のpH領域を除く、全てのpH領域でΔrG₀total 値変化の総和 が負の値です。
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] =2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]= 0
(1)pKa以下のpH領域及び(4)pKa以上のpH領域でΔrG₀total 値変化の総和 が零(0)です。
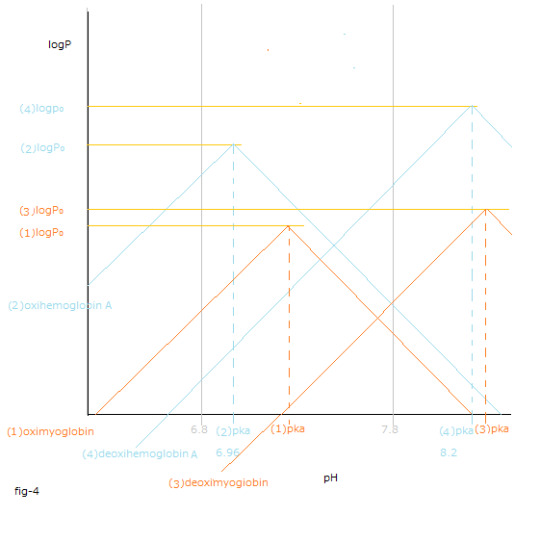
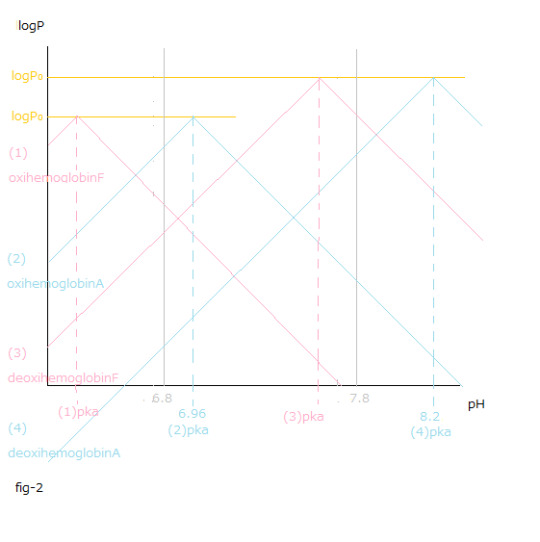
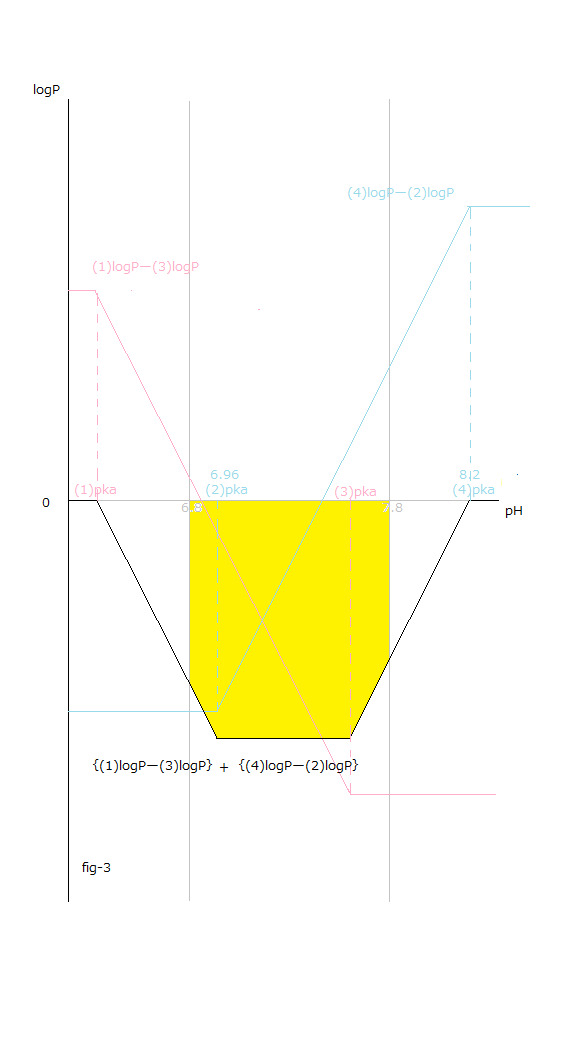
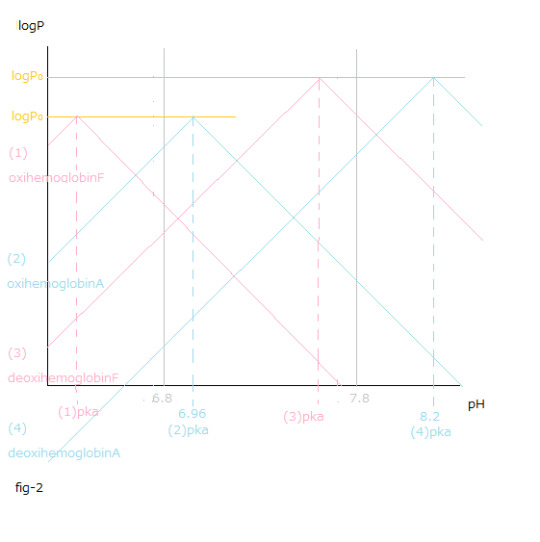
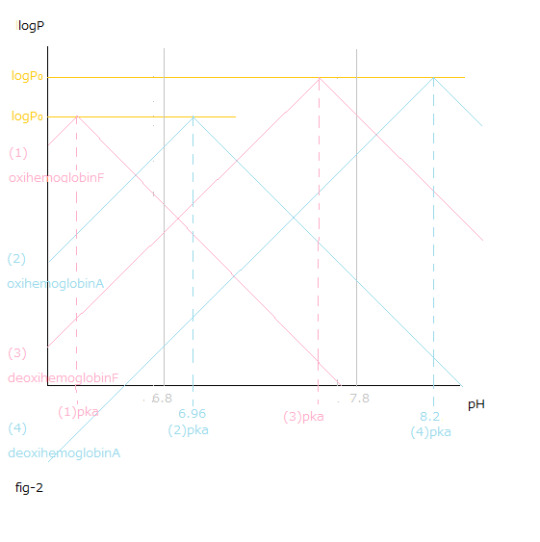
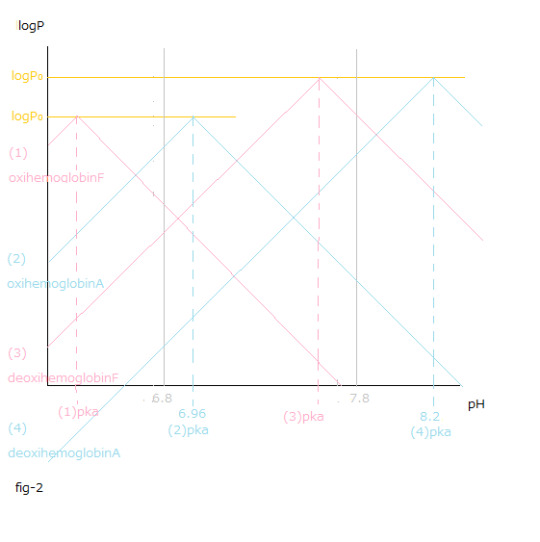
pH値変化と(1)~(4)logP値変化との関係はfig-2から読み取ることが出来ます。
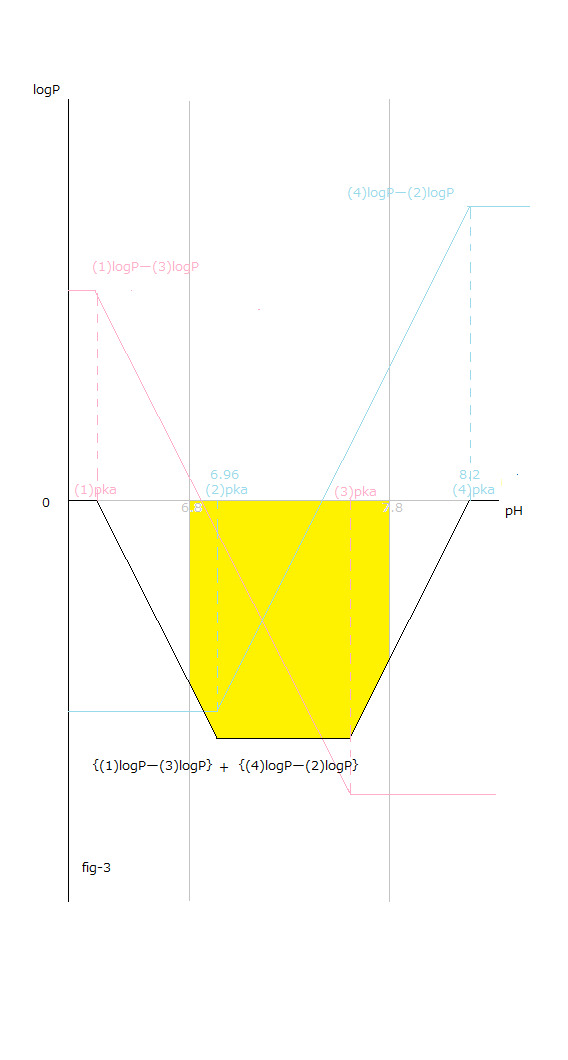
pH値変化と[logP値変化の総和 X (ー1)]=[{(1) logPー(3)logP }+{(4) logPー(2)logP }]との関係はfig-3から読み取ることが出来ます。
(1)pKa以下のpH領域及び(4)pKa以上のpH領域を除く全てのpH領域
(2)オキシヘモグロビンAから(3)デオキシヘモグロビンFへ酸素分子が移動する際、
(1)pKa以下のpH領域及び(4)pKa以上のpH領域を除く全てのpH領域内で[logP値変化の総和 X (ー1)]=[{(1) logPー(3)logP }+{(4) logPー(2)logP }]が負であるから、
ΔrG₀変化の総和 は負となります。
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] =2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0
このことは当該水溶液中の酸素分子が移動する際における、
溶質のギブスエネルギー値変化の総和が負の値となる事を類推出来ることを意味します。
(1)pKa以下のpH領域及び(4)pKa以上のpH領域を除く、全てのpH領域でΔrG₀total 値変化の総和 が負なので、
水溶液中における溶質のギブスエネルギー値変化の総和(ΔrG₀aqtotal<0)も負になります。
(1)pKa~(2)pKaにおいてΔΔrG₀total <0 です。 この時のΔΔrG₀aqtotalも異なる絶対値において負の値になります。 (2)pKa~(3)pKaにおいてΔΔrG₀total =0 です。 この時のΔΔrG₀aqtotalも零(0)になります。 (3)pKa~(4)pKaにおいてΔΔrG₀total >0 です。 この時のΔΔrG₀aqtotalも異なる絶対値において正の値になります。
ここで水層のpH値が変動する際の溶質のギブスエネルギー値の変動についてもう少し検討します。
溶質とイオン化した溶質とでは水層中で示す性質と、有機層中で示す性質には大きな違いがあります。
イオン化した溶質は水層中で強く良溶媒和を受けてギブスエネルギー値の低下に貢献します。
イオン化した溶質は有機層中で強く貧溶媒和を受けてギブスエネルギー値の上昇に貢献します。
イオン化した溶質の両層に於けるギブスエネルギー値の差は、溶媒和の相違により非常に大きくなります��
ボルツマン分布から有機層に移動するイオン化した溶質の量(分子の数)は非常に小さくなり、実質的には零になります。
そのことはイオン化した溶質は有機層でのギブスエネルギー値の上昇に貢献できない事を意味します。
即ち、水層でpH値が変動しても実質的に有機層での溶質のギブスエネルギー値に変動を齎(もたら)すことがないことを意味します。
有機層中での溶媒和に変動がないからです。 ΔrG₀orgtotal=0 ΔΔrG₀orgtotal=0
結果として、水層のpH値が変動する際の水層と有機層とに於ける溶質のギブスエネルギー値の差の変動は、
全てが水層に於ける溶質のギブスエネルギー値の変動に起因することになります。
水層中での良溶媒和には大きな変動が生じているからだす。
そうするとΔrG₀total = ΔrG₀orgtotal + ΔrG₀aqtotal = ΔrG₀aqtotal
ΔrG₀total = ΔrG₀aqtotal となります。
fig-3中に於いて 黒色の実線で表したΔrG₀total を見て下さい。
ΔΔrG₀total はpH値の上昇に伴うΔrG₀total の傾きになります。
(1)pKa~(2)pKaにおいてΔΔrG₀total <0 です。 この時のΔΔrG₀aqtotalも同じ絶対値において負の値になります。 (2)pKa~(3)pKaにおいてΔΔrG₀total =0 です。 この時のΔΔrG₀aqtotalも零(0)になります。 (3)pKa~(4)pKaにおいてΔΔrG₀total >0 です。 この時のΔΔrG₀aqtotalも同じ絶対値において正の値になります。
logP値は水層と有機層との存在を前提に示される数値であるにも拘らず、
水層のpH値が変動する際のギブスエネルギー値の差の変動は実質的に全て、
水層でのギブスエネルギー値の変動に帰することになります。
そのことは血液中でのヘモグロビンの熱力学的考察には好都合となりました。
(2)オキシヘモグロビンAと(3)デオキシヘモグロビンFとから(4)デオキシヘモグロビンAと(1)オキシヘモグロビンFとを生じる際の化学反応に基づくギブスエネルギー値の変化の総和
(2)オキシヘモグロビンAと(3)デオキシヘモグロビンFとから
(4)デオキシヘモグロビンAと(1)オキシヘモグロビンFとを生じる際の、
酸素分子の移動を伴う化学反応に基づくギブスエネルギー値の変化の総和は、事実上相殺関係にあることから考慮しないものとしました。
(2)オキシヘモグロビンAから(3)デオキシヘモグロビンFへの酸素分子の移動
pH値の変動に基づく、当該酸素分子が移動する際の出発物質と生成物のギブスエネルギー値の変化を考慮の対象としました。
(2)オキシヘモグロビンAから(3)デオキシヘモグロビンFへの酸素分子の移動は、
(1)pKa以下のpH領域及び(4)pKa以上のpH領域を除く、
全てのpH領域で自発的に進行する過程(自発過程)であります。
即ち人の血液のpH領域内では常に自発過程となることを説明しました。
(1)pKa以下のpH領域及び(4)pKa以上のpH領域
(1)pKa以下のpH領域及び(4)pKa以上のpH領域では化学平衡が成立します。
(1)pKa以下のpH領域及び(4)pKa以上のpH領域では[logP値変化の総和 X (ー1)]=[{(1) logPー(3)logP }+{(4) logPー(2)logP }]が零(0)であるから、
ΔrG₀total 値変化の総和 も零(0)になります。
ΔrG₀total 値変化の総和 が零(0)なので、水溶液中における溶質のギブスエネルギー値変化の総和(ΔrG₀aqtotal)も零(0)になります。
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] =2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]= 0
(1)pKa以下のpH領域及び(4)pKa以上のpH領域でΔrG₀aqtotal 値変化の総和 も零(0)です。
(1)pKa以下のpH領域及び(4)pKa以上のpH領域でも、
(2)オキシヘモグロビンAと(1)オキシヘモグロビンFとの濃度が等しくなるまでは、
(2)オキシヘモグロビンAから(3)デオキシヘモグロビンFへ酸素分子が移動する可能性があります。
しかし、(1)pKa以下のpH領域及び(4)pKa以上のpH領域は、
人の血液のpH領域以外のpH領域なのでこれ以上の議論をする必要はありません。
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (5).
A rewrite of "The first thermodynamics in the world with regard to hemoglobin (5)."
The transfer of oxygen molecules from (2)oxyhemoglobinA to (3)deoxyhomoglobinF.
A means Adult including mother and F means Fetus.
I'll explain that the transfer of oxygen molecules from mother to fetus is a spontaneous process.
The pH value of human blood is 6.8~7.8,
the pKa value of (4)deoxyhomoglobinA is 8.2,
the pKa value of (2)oxyhomoglobinA is 6.96,
it assumed that(1)logP₀ and (2)logP₀ or (3)logP₀ and (4)logP₀ are approximately the same value.
When the oxygen molecules transfer from mother to fetus, (4)deoxyhemoglobinA and (1)oxyhemoglobinF are produced from (2)oxyhemoglobinA and (3)deoxyhemoglobinF.
Then, I'll explain that the sum total of Gibbs energy changes that occur during the transfer of oxygen molecules is negative.
Due to ⊿G=ーRTlnP=ー2.3RTlogP, it is possible to judge ΔG by discussing logP.
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0
ΔrG₀total = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0
The sum total of Gibbs energy changes X (ー1) =[{(1) logPー(3)logP }+{(4) logPー(2)logP }]is a negative value in all pH regions except pH regions below (1)pKa and above (4)pKa.
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] =2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]= 0
The sum total of Gibbs energy changes is zero(0) in the pH region below (1)pKa and above (4)pKa.
The relationship between the pH value changes and (1)~(4)logP value changes can be read from fig-2.
The relationship between the pH value changes and the sum total of logP value changes X (ー1) =[{(1) logPー(3)logP }+{(4) logPー(2)logP }] can be read from fig-3.
In all pH regions except pH regions below (1)pKa and above (4)pKa.
When the oxygen molecules transfer to (3)deoxyhemoglobinF from (2)oxyhemoglobinA,
the sum total of changes in logP value [{(1) logPー(3)logP }+{(4) logPー(2)logP }] is negative in all pH regions except pH regions below (1)pKa and above (4)pKa,
so the inequality ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] = 2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]< 0 is established.
This means that the sum total of changes in the Gibbs energy value of the solute can be known by analogy to be negative in the transfer of oxygen molecules in the aqueous solution.
Due to that the sum total of changes in Gibbs energy value of the solute is negative in all pH regions except pH regions below (1)pKa and above (4)pKa,
the sum total of changes in Gibbs energy value of the solute in aq layer (ΔrG₀aqtotal) becomes negative.
In (1)pKa~(2)pKa ΔΔrG₀total <0, at this time ΔΔrG₀aqtotal is also nagative at differnt absolute values. In (2)pKa~(3)pKa Δ��rG₀total =0, at this time ΔΔrG₀aqtotal is also zero (0). In (3)pKa~(4)pKa ΔΔrG₀total >0, at this time ΔΔrG₀aqtotal is also positive at differnt absolute values.
Here, I'll consider a little more about the fluctuations in the Gibbs energy value of the solute when the pH value of the aqueous layer fluctuates.
There is a big differnce between the properties of solutes and ionized solutes in the aqueous layer and the properties of them exhibited in the organic layer.
The ionized solute is strongly good solvated in the aqueous layer and contributes to a decrease in the Gibbs energy value of the ionized solute.
The ionized solute is strongly poor solvated in the organic layer and contributes to an increase in the Gibbs energy value of the ionized solute.
The difference in Gibbs energy values of the ionized solutes between two layers is very large due to the difference in solvation.
Due to the Boltzmann distribution the amount of ionized solute (number of molecules) moving from the aqueous layer to the organic layer becomes very small, practically zero.
This means that the ionized solute cannot contribute to the increase in the Gibbs energy value of the solute in the organic layer.
In the other words, a fluctuation in the pH value in the aqueous layer does not cause a substantial change in the Gibbs energy value of the solute in the organic layer.
It is because of no fluctuation of poor solvation in the organic layer. ΔrG₀orgtotal=0 and ΔΔrG₀orgtotal=0
As a result, when the pH value of the aqueous layer fluctuates, all the difference in the Gibbs energy value of the solutes between the aqueous layer and organic layer is due to fluctuation in the Gibbs energy value of the solute in the aqueous layer.
It is because of a large fluctuation of good solvation in the aqueous layer.
Then ΔrG₀total = ΔrG₀orgtotal + ΔrG₀aqtotal = ΔrG₀aqtotal ΔrG₀total=ΔrG₀aqtotal is established.
See ΔrG₀total shown by the solid black line in fig-3.
ΔΔrG₀total is the slope of ΔrG₀total as the pH value increase.
In (1)pKa~(2)pKa ΔΔrG₀total <0, at this time ΔΔrG₀aqtotal is also nagative at the same absolute values. In (2)pKa~(3)pKa ΔΔrG₀total =0, at this time ΔΔrG₀aqtotal is also zero (0). In (3)pKa~(4)pKa ΔΔrG₀total >0, at this time ΔΔrG₀aqtotal is also positive at the same absolute values.
Despite the fact that the logP value is a numerical value indicated on the premise of existence of an aqueous layer and an organic layer,
when the pH value of the aqueous layer fluctuates virtually all the fluctuations of Gibbs energy values will be attributed to the fluctuations of Gibbs energy values in the aqueous layer.
This is advantageous for the thermodynamics study of hemoglobin in the blood.
When (4)deoxyhemoglobinA and (1)oxyhemoglobinF are produced from (2)oxyhemoglobinA and (3)deoxyhemoglobinF, the sum total of changes in Gibbs energy values based on chemical reactions involving the movement of oxygen molecules has not been taken into consideration, due to the sum total is effectively in a cancelling out relationship.
The changes in Gibbs energy value of the starting materials and prducts based on the fluctuation of the pH value have been taken into the consideration.
The transfer of oxygen molecules to (3)deoxyhemoglobinF from (2)oxyhemoglobinA is spontaneous in all pH regions except pH regions below (1)pKa and above (4)pKa.
In other words it's always spontaneous in human blood.
In the pH regions below (1)pKa and above (4)pKa
In the pH regions below (1)pKa and above (4)pKa the chemical equilibrium is established.
Due to that the sum total of logP value changes X (ー1) =[{(1) logPー(3)logP }+{(4) logPー(2)logP }]is zero(0) in the pH regions below (1)pKa and above (4)pKa,
the sum total of changes in Gibbs energy value of the solute aq layer (⊿rG₀aqtotal) is also zero(0).
ΔrG₀total = ー2.3RT[{(3) logPー(1)logP }+{(2) logPー(4)logP }] =2.3RT[{(1) logPー(3)logP }+{(4) logPー(2)logP }]= 0
In the pH regions below (1)pKa and above (4)pKa there might occur the transfer of oxygen molecules to (3)deoxyhemoglobinF from (2)oxyhemoglobinA untill the densities of (2)oxyhemoglobinA and (3)deoxyhemoglobinF become equal.
Since the pH region below (1)pKa and above (4)pKa are the regions which is other than the pH region of human blood there's no need to discuss about it further more.

#mother#fetus#spontaneous#deoxyhemoglobinA#oxyhemoglobinA#deoxyhomoglobinF#oxyhemoglobinF#Gibbs energy
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (4)
書き換えた"世界で初めてのヘモグロビン・サーモダイナミックス(4)"
分配係数の対数 logP について
オクタノール(org)と純水(aq)との間における溶質の分配比を分配係数(P)とします。
P = Porg/Paqです。logPはその対数です。
logP = log(Porg/Paq) 分配比が等しい時に logP = log 1 = 0 になります。
溶質の水との親和力が大きくなるとlogPの値は負の値になります。
logP = log(small/large) < 0
分配係数の対数とギブスエネルギー値
ある溶質の有機層(org層)におけるギブスエネルギー値と、
その溶質の水層(aq層)におけるギブスエネルギー値の差をΔrG₀とすると、
ΔrG₀とlogPとの間には次の等式が成立します。
ΔrG₀ =rG₀(org)ーrG₀(aq) = ーRTlnP = ー2.3 RT logP
(私の頭の中では式 P=exp{ーΔrG₀ /RT} の方が理解しやすいくなっています。)
pHの変動に応じた溶質のΔrG₀の変動を評価することが出来ます。
溶液のpH値と溶質のpKa値とギブスエネルギー値変化の総和
斯かる場合には、溶質のpKa値が重要な意味を持ちます。
溶質が両性イオンである時には、
等電点(pI)のpH値をpKa値として用います。(以下同じ。)
複数の物質が関与する化学変化における、
ギブスエネルギー値変化の総和であるΔrG₀totalの変動を、
評価することも出来ます。
ただし、このΔrG₀は水層中の溶質のギブスエネルギー値を直接表すものではなく、
溶質とaqの他にorgの存在を前提とする値なのです。
それでも水層中の溶質のギブスエネルギー値が反映された値であり、
水層中の溶質のギブスエネルギー値と無関係ではありません。
このΔrG₀は水溶液中の溶質のギブスエネルギー値と密接に関連した値であるから、
水層中の溶質のギブスエネルギー値変化の相対的な評価をすることが出来ます。
(後には絶対的な評価をすることができます。)
酸素分子が体の組織の末端に届けられることについては、
当該相対的な評価を理解することで足ります。
純水に酸または塩基を加えると溶質と水との親和力に変動が生じます。
今論じているのは両性イオンであるからpKa値は等電点(pI)のpH値になります。
pKa値(pI)を有する両性イオンである溶質のlogP値及びΔrG₀は、
次の式で与えられます。
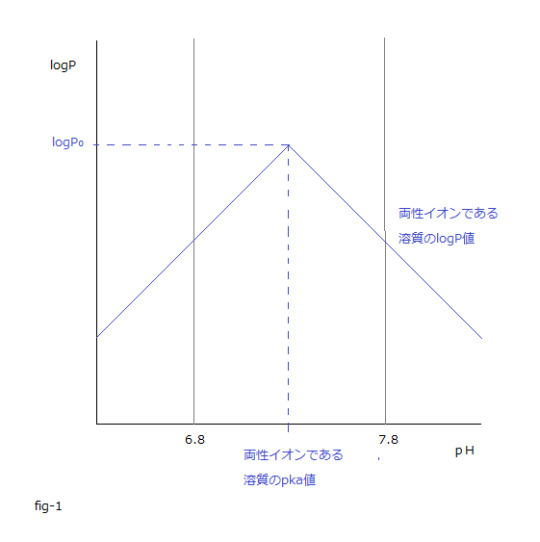
logP = logP₀-| pKa ー pH |
ΔrG₀ = ー2.3 RT ( logP₀ - | pKa ー pH | )
aq層のpH値が両性イオンである溶質のpKa値と同じになった時の、
その両性イオンである溶質のlogP値がlogP₀値になります。
グラフから分かるようにその両性イオンである溶質のlogP₀値は、
その両性イオンである溶質のlogP値の最大値になります。
下記fig-1は上記の理解を容易にします。
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (4).
A rewrite of "The first thermodynamics in the world with regard to hemoglobin (4)."
About logP which is the logarithm of partition coefficient(P).
The partition coefficient(P) is the distribution ratio of the solute between octanol(org) and pure water(aq).
P(the partition coefficient) = Porg/Paq logP is its logarithm.
When the partition coefficients are equal, logP = log1 = 0
The value of logP is negative due to the increase of affinity between solute and water. logP = log(small/large) < 0
The logarithm of partition coefficient and the value of Gibbs energy.
When the difference between the Gibbs energy of solute in org layer and one in aqueous layer is ⊿rG₀, the following equation is established between ⊿rG₀ and logP.
ΔrG₀ =rG₀(org)ーrG₀(aq)
ΔrG₀ = ーRTlnP = ー2.3 RT logP
(In my mind, P = exp{ーΔrG₀/RT} is easier to understand.)
It is possible to evaluate the variation of ΔrG₀ of the solute accouding to pH fluctuations.
The pH value of a solution and the pKa value and ΔG₀ of a solute
In this case, the pKa value of solute is important.
When the solute is an amphoteric ion, the pH value of isoelectric point (pl) is the pKa value. (The same shall apply heteinafter.)
In chemical changes involving multiple substances, you can evaluate the variation of ΔrG₀total which is the sum of changes in Gibbs energy value.
However this ΔrG₀ doesn't directry represent the Gibbs energy value of solute in the aqueous layer,
it's a value that assumes the existence of an org layer in addition to the solute and aq layer.
It's still a value that reflects the Gibbs energy value of solute in the aqueous layer, it isn't unrelated to the Gibbs energy value of solute in the aqueous layer.
Since this ΔrG₀ is closely related to the Gibbs energy value of solute in the aqueous layer, it is possible to evaluate the relative change in the Gibbs energy value of solute in aqueous layer. (An absolute rating can be given later.)
As for the delivery of oxigen molecules to the ends of tissues of body, it is sufficient to understand the relative valuatioin.
Adding an acid or base to pure water causes fluctuations in the affinity between solutes and water.
Since we are discussing an amphoteric ion , the pKa value is the pH value of isoelectric point(pl).
The logP value and ΔG₀ of a solute that is an amphoteric ion having a pKa value(pl) are given by the following formula.
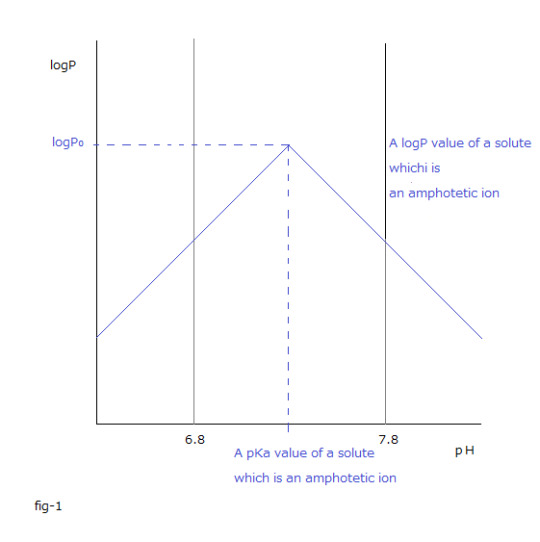
logP = logP₀ー | pKa ー pH |
ΔrG₀ = ー2.3 RT( logP₀ ー | pKa ー pH | )
When the pH value of aq layer becomes the same as the pKa value of solute that is an amphoteric ion, the logP value of solute which is an amphoteric ion is the logP₀ value.
As it can be seen from the graph, the logP₀ value of solute which is an amphoteric ion is the maximum logP value of solute which is the amphoteric.
Fig-1 makes it easier for you to understand mentioned above.
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (11)
水層のpH値が変動する際の溶質のギブスエネルギー値の変動
溶質とイオン化した溶質とでは水層中で示す性質と、有機層中で示す性質には大きな違いがあります。
イオン化した溶質は水層中で強く良溶媒和を受けてギブスエネルギー値の低下に貢献します。
イオン化した溶質は有機層中で強く貧溶媒和を受けてギブスエネルギー値の上昇に貢献します。
イオン化した溶質の両層に於けるギブスエネルギー値の差は、溶媒和の相違により非常に大きくなります。
ボルツマン分布から有機層に移動するイオン化した溶質の量(分子の数)は非常に小さくなり、実質的には零になります。
そのことはイオン化した溶質は有機層でのギブスエネルギー値の上昇に貢献できない事を意味します。
即ち、水層でpH値が変動しても実質的に有機層での溶質のギブスエネルギー値に変動を齎(もたら)すことがないことを意味します。
有機層中での溶媒和に変動がないからです。 ΔrG₀orgtotal=0 ΔΔrG₀orgtotal=0
結果として、水層のpH値が変動する際の水層と有機層とに於ける溶質のギブスエネルギー値の差の変動は、
全てが水層に於ける溶質のギブスエネルギー値の変動に起因することになります。
水層中での良溶媒和には大きな変動が生じているからだす。
そうするとΔrG₀total = ΔrG₀orgtotal + ΔrG₀aqtotal = ΔrG₀aqtotal
ΔrG₀total = ΔrG₀aqtotal となります。
fig-3中に於いて 黒色の実線で表したΔrG₀total を見て下さい。
ΔΔrG₀total はpH値の上昇に伴うΔrG��total の傾きになります。
(1)pKa~(2)pKaにおいてΔΔrG₀total <0 です。 この時のΔΔrG₀aqtotalも同じ絶対値において負の値になります。 (2)pKa~(3)pKaにおいてΔΔrG₀total =0 です。 この時のΔΔrG₀aqtotalも零(0)になります。 (3)pKa~(4)pKaにおいてΔΔrG₀total >0 です。 この時のΔΔrG₀aqtotalも同じ絶対値において正の値になります。
logP値は水層と有機層との存在を前提に示される数値であるにも拘らず、
水層のpH値が変動する際のギブスエネルギー値の差の変動は実質的に全て、
水層でのギブスエネルギー値の変動に帰することになります。
そのことは血液中でのヘモグロビンの熱力学的考察には好都合となりました。
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (11)
Fluctuations in the Gibbs energy value of the solute when the pH value of the aqueous layer fluctuates.
There is a big differnce between the properties of solutes and ionized solutes in the aqueous layer and the properties of them exhibited in the organic layer.
The ionized solute is strongly good solvated in the aqueous layer and contributes to a decrease in the Gibbs energy value.
The ionized solute is strongly poor solvated in the organic layer and contributes to an increase in the Gibbs energy value.
The difference in Gibbs energy values between the two layers of ionized solutes is very large due to the difference in solvation.
Due to the Boltzmann distribution the amount of ionized solute (number of molecules) moving from the aqueous layer to the organic layer becomes very small, practically zero.
This means that the ionized solute cannot contribute to the increase in the Gibbs energy value in the organic layer.
In the other words, a fluctuation in the pH value in the aqueous layer does not cause a substantial change in the Gibbs energy value of the solute in the organic layer.
This is because there is no fluctuation of solvation in the organic layer. ΔrG₀orgtotal=0 and ΔΔrG₀orgtotal=0
As a result, when the pH value of the aqueous layer fluctuates, all the difference in the in Gibbs energy value of the solute between the aqueous layer and organic layer is due to fluctuation in the Gibbs energy value of the solute in the aqueous layer.
This is because there is a large fluctuation in good solvation in the aqueous layer.
Then ΔrG₀total = ΔrG₀orgtotal + ΔrG₀aqtotal = ΔrG₀aqtotal ΔrG₀total=ΔrG₀aqtotal is established.
See ΔrG₀total shown by the solid black line in fig-3.
ΔΔrG₀total is the slope of ΔrG₀total as the pH value increase.
In (1)pKa~(2)pKa ΔΔrG₀total <0, at this time ΔΔrG₀aqtotal is also nagative at the same absolute values. In (2)pKa~(3)pKa ΔΔrG₀total =0, at this time ΔΔrG₀aqtotal is also zero (0). In (3)pKa~(4)pKa ΔΔrG₀total >0, at this time ΔΔrG₀aqtotal is also positive at the same absolute values.
Despite the fact that the logP value is a numerical value indicated on the premise of existence of an aqueous layer and an organic layer,
when the pH value of the aqueous layer fluctuates virtually all the fluctuations of Gibbs energy values will be attributed to the fluctuations of Gibbs energy values in the aqueous layer.
This is advantageous for the thermodynamics study of hemoglobin in the blood.
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (4 の訂正)
世界で初めてのヘモグロビン・サーモダイナミックス (4 )の中で、
logP = logP₀+( pKa ー pH )
ΔrG₀ = ー2.3 RT( logP₀ + pKa ー pH )
上記の式を下記の式に書き換えました。
logP = logP₀ー | pKa ー pH |
ΔrG₀ = ー2.3 RT ( logP₀ ー | pKa ー pH | )
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin (correction of 4)
In The first thermodynamics in the world with regard to hemoglobin (4),
logP = logP₀+( pKa ー pH )
ΔrG₀ = ー2.3 RT( logP₀ + pKa ー pH )
I rewrote the above-mentioned formulae into the following fomulae.
logP = logP₀ー | pKa ー pH |
ΔrG₀ = ー2.3 RT ( logP₀ ー | pKa ー pH | )
0 notes
Text
The first thermodynamics in the world with regard to hemoglobin
The conclusion at the end of the blog has been rewritten as unfinished.
0 notes
Text
Congratulations Hanshin Tigers!
Congratulations Hanshin Tigers!
It's great to see the Hanshin Tigers at the pinnacle of Japan Baseball.
おめでとおうがざいます!
阪神タイガースが日本野球の頂点に立つのを見るのは素晴らしいことです。
0 notes
Text
世界で初めてのヘモグロビン・サーモダイナミックス (10)
自発過程とギブスエネルギー変化の負の値
ギブスエネルギーについての説明
ある系内における熱力学関数の変化によって、
自発的な現象を説明できる簡便な方法を確立しました。
それがギブスエネルギー(G)と呼ばれる関数で、
次の式で与えられます。
G=H-TS
Gはギブスエネルギーで、単位はカロリー又はジュール
Hはエンタルピーで、単位はカロリー又はジュール
Tは絶対温度で、単位はK°(度K) (絶対零度はー273.15℃)
Sはエントロピーで、単位はカロリー/絶対温度又はジュール/絶対温度
自発過程を表す熱力学第二法則の式を変換してみます。
ΔSuniv = ΔSsys + ΔSsurr ≧ 0 (熱力学第二法則の式)
エントロピー(S)は熱量(Q)を温度(T)で除した値なので、
S(エントロピー)=Q/T となり ΔSsurr = ΔQsurr/T となります。
系の温度が外界と熱平衡にある状態で系の温度は一定で出入りした熱量は等しいので、
ΔQsurr/T = -Δ Qsys/T と符号が逆になります。
ΔSuniv = ΔSsys + ΔSsurr ≧ 0 をΔSuniv = ΔSsys-Δ Qsys/T ≧ 0 と書き直し、
両辺に-Tを掛けて-TΔSuniv = Δ Qsys - TΔSsys ≦ 0 とします。
ΔG = -TΔSuniv とおくとΔG = Δ Qsys - TΔSsys ≦ 0 となります。
ギブスエネルギー(G)はG = Qsys - TSsys で表されます。
一定圧力の下で気体に熱量を加えると、
内部エネルギーの増加の他に気体は膨張することで外界に仕事(W)をしてしまいます。
上記の理由から気体の全エネルギーを考える時には、
内部エネルギー(U)とは別個のエネルギーを考慮する必要が出てきます。
そうした観点から内部エネルギー(U)と外界にした仕事(W)との和から成る、
気体の全エネルギーをエンタルピー(H)としました。
外界にした仕事(W)は次の式で表されます。 W=PV
Pは圧力で、単位は気圧(atm)
Vは体積で、単位はリットル(ℓ)
1 l atm (リットル・アトモスファー) = 0.10204 kJ≒0.1 kJ (キロジュール)
H = U + PV
G = Qsys - TSsys
式中 Qsysは気体を含むことのある系に加えられた熱量。
Qsys = Hsys であるから、
G =Qsys - TSsys = Hsys - TSsys となります。
ある系内における熱力学関数となったのでsysを省略します。
G = H - TSとなります。
一定温度 (温度変化を無視し得る条件) の下で、
ギブスエネルギー値(G)の変化は次の式で表されます。
ΔG= ΔH - TΔS
ΔG = ΔH - TΔS ≦ 0 のときにその系の変化は自発過程となります。
ΔG = Δ Qsys - TΔSsys ≦ 0 と ΔG = ΔH - TΔS ≦ 0 とは同じ式です。
系内のギブスエネルギー(G)の変化量(ΔG )を評価することで自発過程についての判断が出来ます。
完
参考文献:
生命科学系のための物理化学
Raymond Chang著 岩澤 康裕・北川 禎三・濱口 宏夫 訳
東京化学同人
エントロピーの正体 アリー・ベン=ナイム著 小野喜之 訳
丸善出版株式会社
0 notes
